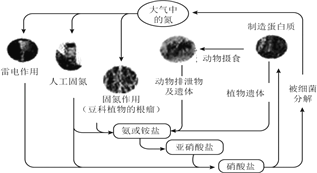
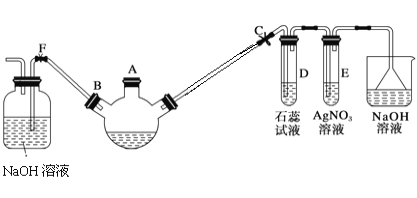
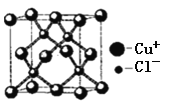
题目内容
【题目】从分类的角度来看,下列说法正确的是( )
A.硅酸、氯化铁均为胶体
B.水玻璃、氯水均为混合物
C.食醋、纯碱、食盐分别属于酸、碱盐
D.氨气属于非电解质,Cu属于电解质
【答案】B
【解析】A.硅酸是纯净物,不属于胶体,氯化铁也不是胶体,故A不符合题意;
B.水玻璃是硅酸钠溶液,氯水是氯气溶于水后混合物,它们都是混合物,故B符合题意;
C.纯碱是碳酸钠,属于盐,故C不符合题意;
D.氨气在水溶液和熔融状态下都不能自身电离而导电,属于非电解质;Cu是单质,既不是电解质也不是非电解质,故D不符合题意.故选B根据化学物质的分类方法进行判断分类是否正确即可.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目