题目内容
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
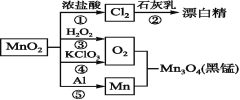
利用下图所示装置进行实验。
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 。装置④中产生NaClO2的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c molL-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(4)滴定中使用的指示剂是 。
(5)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
【答案】
(1)吸收多余的ClO2气体,防止污染环境;防止倒吸(或作安全瓶等其它正确说法);
(2)2NaClO3+Na2SO3+H2SO4(浓)==2ClO2↑+2Na2SO4+H2O;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)用38℃~60℃的温水洗涤;
(4)淀粉溶液;(5)![]() 或
或![]() ;
;
【解析】
试题分析:(1)装置中有未反应的ClO2,装置①可以吸收未反应的ClO2,防止逸出污染空气;装置④中气体反应,装置内压强降低,装置③防止倒吸;故答案为:吸收未反应的ClO2,防止逸出污染空气;防止倒吸;
(2)亚硫酸钠具有还原性,在反应中作还原剂,装置②中产生ClO2的反应是氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,反应的化学方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;装置④反应后的溶液获得NaClO2晶体,故装置④中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO23H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,故答案为:用38℃~60℃热水洗涤;
(4)碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点,故答案为:淀粉溶液;
(5)令样品中NaClO2的质量分数为a,则:
NaClO2~2I2~4S2O32-
90.5g 4mol
mag cmolL-1×V×10-3L×![]()
所以90.5g:mag=4mol:c molL-1×V×10-3L×![]() ,解得a=
,解得a=![]() %,故答案为:
%,故答案为:![]() %。
%。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】反应:MgSO4(s) + CO(g)![]() MgO(s)+CO2(g)+SO2(g) ΔH>0。在恒容密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g) ΔH>0。在恒容密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,y随x变化趋势合理的是
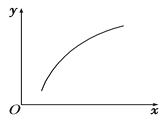
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验 编号 | NaOH溶液 的浓度(mol/L) | 滴定完成时,消耗NaOH 溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.02 | 20.00 |
2 | 0.10 | 22.00 | 20.00 |
3 | 0.10 | 21.98 | 20.00 |
(1)滴定达到终点的现象是 ;此时锥形瓶内溶液的pH的范围是 。
(2)根据上述数据,可计算出该盐酸的浓度为 。
(3)排去碱式滴定管中气泡的方法应采用右图的 操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。


(4)右图是某次滴定时的滴定管中的液面,其读数为________mL。
(5)下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有 。
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数;
E.碱式滴定管尖嘴部分有气泡,滴定后消失