题目内容
【题目】图中A,B,C,D,E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.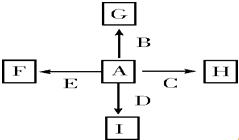
已知:①反应C+G ![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:2E+I
B+H能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:2E+I ![]() 2F+D,F中E元素的质量分数为60%.问题:
2F+D,F中E元素的质量分数为60%.问题:
(1)①中反应的化学方程式为 .
(2)化合物I的化学式为 .
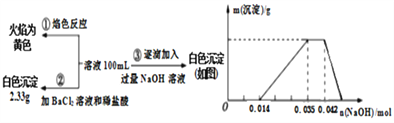
(3)C与过量NaOH溶液反应的离子方程式为 , 反应后溶液与过量化合物I反应的离子方程式为(注:不要求写OH﹣+CO2═HCO3﹣).
(4)E在I中燃烧观察到的现象是 .
【答案】
(1)2Al+Fe2O3 ![]() Al2O3+2Fe
Al2O3+2Fe
(2)CO2
(3)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,AlO2﹣+CO2+2H2O=HCO3﹣+Al(OH)3↓
(4)镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳
【解析】解:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,
①反应C+G ![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,
B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,
②I是一种常见的温室气体,则I为CO2,它和E可以发生反应:2E+I ![]() 2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2.
2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2.
(1)①中反应的化学方程式为2Al+Fe2O3 ![]() Al2O3+2Fe,
Al2O3+2Fe,
所以答案是:2Al+Fe2O3 ![]() Al2O3+2Fe;
Al2O3+2Fe;
(2)I为二氧化碳,其化学式为CO2,
所以答案是:CO2;
(3)C与过量NaOH溶液反应的化学方程式为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,反应后溶液与过量化合物Ⅰ反应的化学方程式为AlO2﹣+CO2+2H2O=HCO3﹣+Al(OH)3↓、CO2+OH﹣=HCO3﹣,
所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;AlO2﹣+CO2+2H2O=HCO3﹣+Al(OH)3↓;
(4)E在I中燃烧可能观察到的现象是镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳,
所以答案是:镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案