题目内容
对于反应2X(g)+Y(g)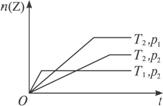
A.T1<T2,p1<p2,正反应为放热反应 B.T1<T2,p1>p2,正反应为吸热反应
C.T1>T2,p1>p2,正反应为放热反应 D.T1>T2,p1<p2,正反应为吸热反应
解析:本题主要考查温度和压强对反应速率和化学平衡的影响。在相同压强(p2)下,温度越高,化学反应速率越快,达平衡时所需时间越短,故T1>T2;在相同温度(T2)下,压强越大,化学反应速率越快,达平衡时所需时间越短,故p1>p2。由于温度升高,平衡向吸热反应方向移动,由图不难看出正反应为放热反应。
答案:C

练习册系列答案
相关题目
对于反应2X(g)+Y(g)  2Z(g),下列说法正确的是( )
2Z(g),下列说法正确的是( )
| A.由于K=c2(Z)/[c2(X)·c(Y)],随着反应的进行,Z的浓度不断增大,X,Y的浓度不断减小,平衡常数不断增大 |
| B.当温度不变时,增大反应物的浓度,使K变小;增大生成物的浓度,使K增大 |
| C.可逆反应达到平衡时,逆反应便立即停止了 |
| D.温度发生变化,上述的K值也发生变化 |

 2Z(g),下列说法正确的是( )
2Z(g),下列说法正确的是( ) 2Z(g),下列说法正确的是
2Z(g),下列说法正确的是