题目内容
标准状况下1.68 L气态烃在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0 g;若用足量碱石灰吸收燃烧产物,增重9.3 g。
(1)计算燃烧产物中水的质量。
(2)通过计算推断气态烃的分子式。
(1)计算燃烧产物中水的质量。
(2)通过计算推断气态烃的分子式。
(1)2.7g (2分) (2)C2H4(3分)
试题分析:(1)白色沉淀是碳酸钙,物质的量是15g÷100g/mol=0.15mol
所以根据碳原子守恒可知CO2的物质的量也是0.15mol
CO2的质量是0.15mol×44g/mol=6.6g
所以生成物水的质量是m(H2O)=9.3g-6.6g=2.7 g
(2)
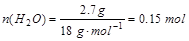
所以分子中C:H=1:2
由于n(无色可燃气体)=
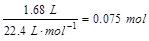
所以分子中C原子数=
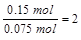
分子中H原子数=2×2=4
因此该气体的分子式是C2H4
点评:该题是基础性试题的考查,难度不大。试题基础性强,侧重对学生基础知识的巩固和训练,旨在培养学生的逻辑推理能力和规范的答题能力,也有利于提高学生的应试能力和学习效率。该题的关键是利用好原子守恒以及质量守恒等。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目



