题目内容
下列说法正确的是
| A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO3- =4Mg2++NH4++3H2O |
| B.25℃时,将20 mL 0.1mol·L-1H2SO4溶液和30 mL 0.15mol·L-1NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11 |
| C.将10 mL 0.1 mol·L-1KAl(SO4)2溶液和10 mL0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2 |
| D.浓度均为0.1 mol·L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
D
试题分析:A项离子方程式电荷不守恒,A错;B项混合后溶液中的c(OH-)=
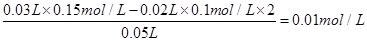 ,因此溶液的pH为12,B错;根据C项中的数据,c(Al3+):c(OH-)=(0.01×0.1):(0.01×0.2×2)=1:4,因此Al3+恰好完全转化为AlO2-,不会生成沉淀,C错;等体积、等浓度的醋酸和CH3COONa溶液混合后,根据电荷守恒有c(H+)+c(Na+)=c(OH-)+c(CH3COO-),根据物料守恒有c(CH3COOH)+c(CH3COO-)="2" c(Na+),结合两个等式可得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),D正确。
,因此溶液的pH为12,B错;根据C项中的数据,c(Al3+):c(OH-)=(0.01×0.1):(0.01×0.2×2)=1:4,因此Al3+恰好完全转化为AlO2-,不会生成沉淀,C错;等体积、等浓度的醋酸和CH3COONa溶液混合后,根据电荷守恒有c(H+)+c(Na+)=c(OH-)+c(CH3COO-),根据物料守恒有c(CH3COOH)+c(CH3COO-)="2" c(Na+),结合两个等式可得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),D正确。
练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
 ,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。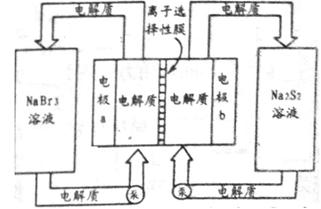
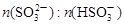 关系如下表:
关系如下表: