题目内容
在一密闭气缸中,用一不漏气可滑动的活塞隔开,左边充有N2,右边充有H2和O2的混合气体,在20℃时,将右边混合气体点燃,反应后冷却到原来温度,若活塞原来离气缸左端的距离为总长的
,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比可能为( )
| 1 |
| 4 |
分析:左室中氮气的物质的量不变,令开始氮气的物质的量为1mol,左右两室压强相同,体积之比等于物质的量之比,据此计算开始右室中氢气与氧气的物质的量,反应后左右体积相等,则右室剩余气体的物质的量为1mol,该气体可能是氧气或氢气,根据差量法计算,原混合气体中氢气、氧气的物质的量,进而计算体积比.
解答:解:左室中氮气的物质的量不变,令开始氮气的物质的量为1mol,左右两室压强相同,体积之比等于物质的量之比,故开始右室中氢气与氧气的物质的量为1mol×
=3mol,反应后左右体积相等,则右室剩余气体的物质的量为1mol,则:
2H2+O2=2H2O 气体物质的量减少△n
2 1 3
mol
mol 3mol-1mol=2mol
若剩余气体为氢气,则原混合气体中氧气为
mol,则氢气为3mol-
mol=
mol,H2和O2的体积比为
mol:
mol=7:2,
若剩余气体是氧气,则原混合气体中氢气为
mol,则氢气为3mol-
mol=
mol,H2和O2的体积比为
mol:
mol=4:5,
故选A.
| ||
|
2H2+O2=2H2O 气体物质的量减少△n
2 1 3
| 4 |
| 3 |
| 2 |
| 3 |
若剩余气体为氢气,则原混合气体中氧气为
| 2 |
| 3 |
| 2 |
| 3 |
| 7 |
| 3 |
| 7 |
| 3 |
| 2 |
| 3 |
若剩余气体是氧气,则原混合气体中氢气为
| 4 |
| 3 |
| 4 |
| 3 |
| 5 |
| 3 |
| 4 |
| 3 |
| 5 |
| 3 |
故选A.
点评:本题考查化学计算、阿伏伽德罗定律等,难度中等,根据左室氮气的物质的量利用体积判断右室气体的物质的量是关键.

练习册系列答案
相关题目
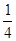 ,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为________________
,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为________________