题目内容
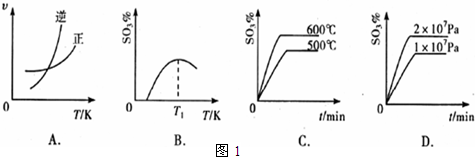
改变下列哪个条件,一定会引起平衡的移动( )
| A.温度 | B.浓度 | C.压强 | D.催化剂 |
A、任何化学反应一定伴随能量的变化,升高温度,化学平衡一定是向着吸热方向进行,故A正确;
B、前后气体体积不变的反应,同等程度改变反应混合物的浓度不会引起平衡的移动,故B错误;
C、对于没有气体参加的反应,或是前后气体体积不变的反应,压强改变不会引起平衡的移动,故C错误;
D、使用催化剂只能改变化学反应的速率,不会引起化学平衡的移动,故D错误.
故选A.
B、前后气体体积不变的反应,同等程度改变反应混合物的浓度不会引起平衡的移动,故B错误;
C、对于没有气体参加的反应,或是前后气体体积不变的反应,压强改变不会引起平衡的移动,故C错误;
D、使用催化剂只能改变化学反应的速率,不会引起化学平衡的移动,故D错误.
故选A.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目