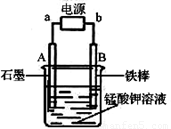
题目内容

(1)KMnO4稀溶液是一种常用的消毒剂,其消毒原理与下列物质相同的是
a.84消毒液(NaClO溶液) b.双氧水 c.福尔马林(35%甲醛溶液) d.75%酒精
(2)高锰酸钾保存在棕色试剂瓶中,下列试剂保存不需要棕色试剂瓶的是
a.浓硝酸 b.硝酸银 c.氯水 d.烧碱
(3)上述流程中可以循环使用的物质有
(4)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得
| 2 |
| 3 |
| 2 |
| 3 |
(5)写出实验室用KMnO4制备气体的一个化学方程式
| ||
| ||
(6)操作Ⅰ的名称是
(2)见光易分解的物质常常保存在棕色试剂瓶中;
(3)最初反应物中和最终生成物中含有的物质就能循环利用;
(4)根据氧化还原反应中得失电子守恒计算高锰酸钾和二氧化锰的比值;
(5)实验室用KMnO4制取O2,高锰酸钾受热分解生成锰酸钾、二氧化锰、氧气,据此解答;
(6)分离固体与溶液,采用过滤操作,利用KMnO4和K2CO3在溶解性上进行分离;
a、84消毒液(NaClO溶液),次氯酸钠具有强氧化性,常常利用次氯酸钠的强氧化性进行杀菌消毒,故a正确;
b、双氧水具有强氧化性,常常利用双氧水的强氧化性进行杀菌消毒,故b正确;
c、福尔马林(35%甲醛溶液)是通过渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故c错误;
d、75%酒精是通过酒精渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故d错误;
故选ab;
(2)见光易分解的物质常常保存在棕色试剂瓶中.
a.浓硝酸见光分解生成二氧化氮、氧气和水,所以要保存在棕色试剂瓶中,故a错误;
b.硝酸银见光分解生成银、二氧化氮和氧气,所以要保存在棕色试剂瓶中,故b错误;
c.氯水中的次氯酸见光分解生成盐酸和氧气,所以要保存在棕色试剂瓶中,故c错误;
d.烧碱见光不分解,所以不要保存在棕色试剂瓶中,故d正确;
故选d;
(3)在开始的反应物和最终的生成物中都含有MnO2和KOH,所以二氧化锰和氢氧化钾能循环使用,
故答案为:MnO2、KOH;
(4)根据锰元素守恒知,1molMnO2生成1molK2MnO4,锰酸钾和二氧化碳反应的方程式为 3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3,根据方程式知,1molK2MnO4和二氧化碳反应生成
| 2 |
| 3 |
故答案为:
| 2 |
| 3 |
(5)实验室用KMnO4制取O2,高锰酸钾受热分解生成锰酸钾、二氧化锰、氧气,该反应的化学方程式是2KMnO4
| ||
故答案为:2KMnO4
| ||
(6)该操作是分离固体与溶液,是过滤操作,KMnO4和K2CO3在溶解性上不同采用热的情况下采用浓缩结晶的方式可分离,
故答案为:过滤;浓缩结晶;

 天天向上口算本系列答案
天天向上口算本系列答案高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快。
(1)酸性条件下高锰酸钾溶液分解的离子方程式 。
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:
______MnO4— +______C2O42—+______H+=______Mn2++______CO2↑+____________
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如下表:
滴入高锰酸钾溶液的次序(每滴溶液的体积相同) |
高锰酸钾溶液紫色褪去的时间 |
|
先滴入第1滴 |
1min |
|
褪色后再滴入第2滴 |
15s |
|
褪色后再滴入第3滴 |
3s |
|
褪色后再滴入第4滴 |
1s |
请分析高锰酸钾溶液褪色时间变化的原因 。
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度。他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定。
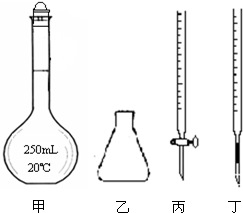
①高锰酸钾溶液应装在 (填下图中的仪器编号)。
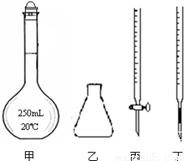
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定时应注意的是 。
③若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是 。
A.未润洗盛放KMnO4的滴定管
B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线
D.锥形瓶用水洗之后未用待测液润洗
④当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为 。
a. 乙醇 b. Na2SO3溶液 c. 环己烯 d. 苯 e. FeSO4溶液
②将用稀硫酸酸化的高锰酸钾溶液滴入盛有足量草酸溶液的试管中,振荡后,观察到的现象是______________。已知1mol草酸参加反应时转移的电子数是2×6.02×1023,锰元素在生成物中的化合价为+2。请写出此反应的化学方程式_____________________。
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.