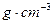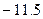题目内容
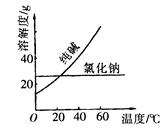
某有机样品3.1g完全燃烧,燃烧后的混合物通入过量的澄清石灰水中,石灰水共增重7.1g,然后经过滤得到10g沉淀.该有机样品可能是
| A.乙醇 | B.乙二醇 | C.乙醛 | D.甲醇和丙三醇的混合物 |
BD
根据题意,l0g沉淀为CaCO3,即产生的二氧化碳为0.1mol即4.4g,其中碳元素质量为:0.1mol×12g/mol=1.2g,石灰水增重7.1g,所以有机物燃烧生成的水的质量为:7.1-4.4=2.7g,即n(C)=0.1mol,n(H)=2.7g/18g/mol×2=0.3mol,氢元素质量为0.3mol×1g/mol=0.3g,有机样品共3.1g,所以O元素物质的质量=3.1g-1.2g-0.3g=1.6g物质的量为:1.6g/16g/mol=0.1mol,碳、氢、氧原子的物质的量之比为1:3:1,即最简式为CH3O,有BD符合,D、CH4O、C3H8O3当物质的量是1:1时,平均最简式也是CH3O;故选BD.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
 D CH3COOCH3
D CH3COOCH3