题目内容
【题目】榴石矿石可以看作CaO,FeO,Fe2O3、A12O3、SiO2组成.工业上对其进行综合利用的流程如下: 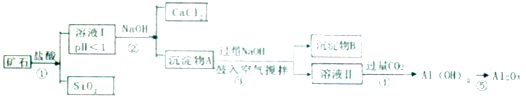
(1)SiO2的用途广泛,试写出其中的一种重要用途;
(2)溶液Ⅰ中除了Ca2+外,还含有的金属阳离子有;
(3)步骤③中NaOH参加反应的离子方程式是 , 鼓入空气并充分搅拌的目的是 .
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是 .
(5)试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象) .
【答案】
(1)制造光导纤维
(2)Fe2+、Fe3+、Al3+
(3)Al(OH)3+OH﹣=AlO2﹣+2H2O;使其中氢氧化亚铁氧化为氢氧化铁
(4)使用二氧化碳可以避免盐酸过量使氢氧化铝溶解,同时二氧化碳容易制备价格便宜
(5)取少量矿石加入稀硫酸溶解后充分反应,滴入高锰酸钾溶液若褪色证明矿石中含有氧化亚铁
【解析】解:榴石矿石可以看作CaO、FeO、Fe2O3、A12O3、SiO2组成,加入盐酸溶解过滤得到滤液中含氯化钙、氯化亚铁、氯化铁、氯化铝、盐酸,固体为SiO2 , 溶液中加入氢氧化钠反应生成氢氧化铁、氢氧化亚铁、氢氧化铝,过滤得到沉淀物A加热过量氢氧化钠通入空气,氧化氢氧化亚铁生成沉淀物氢氧化铁,和溶液Ⅱ为偏铝酸钠溶液,通入过量二氧化碳生成氢氧化铝沉淀,加热分解生成氧化铝;(1)二氧化硅可以制备光导纤维,所以答案是:光导纤维;(2)依据流程分析判断,溶液Ⅰ除去钙离子,含有阳离子Fe2+、Fe3+、Al3+ , 所以答案是:Fe2+、Fe3+、Al3+;(3)步骤③中NaOH参加反应和氢氧化铝反应生成偏铝酸钠溶液,反应的离子方程式为:Al(OH)3+OH﹣=AlO2﹣+2H2O,鼓入空气充分搅拌使为了氢氧化亚铁氧化为氢氧化铁,所以答案是:Al(OH)3+OH﹣=AlO2﹣+2H2O;使其中氢氧化亚铁氧化为氢氧化铁;(4)步骤④通入过量CO2而不加入盐酸的原因是避免盐酸过量使氢氧化铝溶解,二氧化碳制备方法简单价格便宜,所以答案是:使用二氧化碳可以避免盐酸过量使氢氧化铝溶解,同时二氧化碳容易制备价格便宜;(5)取少量矿石加入稀硫酸溶解后充分反应,滴入高锰酸钾溶液若褪色证明矿石中含有氧化亚铁,
所以答案是:取少量矿石加入稀硫酸溶解后充分反应,滴入高锰酸钾溶液若褪色证明矿石中含有氧化亚铁.

【题目】某化学反应2A(g)B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(molL﹣1)随反应时间(min)的变化情况如下表:
时间 | 1 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为molL﹣1min﹣1
(2)实验2中,A的初始浓度c2=molL﹣1 , 反应经20min就达到平衡,可推测实验2中还隐含的条件是 .
(3)设实验3的化学反应速率为v3 , 实验1的化学反应速率为v1 , 则v3v1(填“>”“=”或“<”),且c31.0molL﹣1(填“>”“=”或“<”).
(4)比较实验4和实验1,可推测该反应的正反应是反应(填“吸热”或“放热”),理由是 .
