题目内容
有一种MCFC型燃料电池,该电池所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应为:2H2+O2===2H2O,负极反应:H2+CO32--2e-===H2O+CO2。下列说法正确的是
| A.电路中的电子经正极、熔融的K2CO3、负极后再到正极,形成闭合回路 |
| B.电池放电时,电池中CO32-的物质的量将逐渐减少 |
| C.正极反应为2H2O+O2+4e-===4OH- |
| D.放电时CO32-向负极移动 |
D
解析试题分析:A、原电池中电子只能通过导线传递,溶液中是靠离子的移动而导电,因此该原电池中电子从负极传递到正极,不经过熔融的碳酸钾,A不正确;B、根据电池的电池的总反应式2H2+O2===2H2O可知,电池放电时,电池中CO32-的物质的量不变,B不正确;C、总反应减去负极反应即得到正极反应式,所以正极反应式为2CO2+O2+4e-===2CO32-,C不正确;D、原电池中电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,阴离子则向负极移动,D正确,答案选D。
考点:考查燃料电池的有关判断与应用

对下列装置的叙述错误的是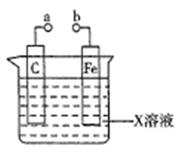
| A.X如果是HCl,则不论a和b用导线连接还是a和b分别连接直流电源正、负极时,H+的移动方向均相同 |
| B.X如果是硫酸铜,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 |
| C.X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应 |
| D.X如果是NaCl,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 |
下列叙述中,正确的是
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电伴随化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化
| A.①②③④ | B.③④ | C.③④⑤ | D.④ |
已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是
| A.充电时作阳极,放电时作负极 |
| B.充电时作阳极,放电时作正极 |
| C.充电时作阴极,放电时作负极 |
| D.充电时作阴极,放电时作正极 |
下列说法正确的是
| A.电解稀硫酸溶液,溶液的浓度会逐渐变大,pH逐渐变大 |
| B.氯碱工业中,电路中每转移1mol电子,理论上收集到1mol气体 |
| C.向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度 |
| D.粗铜精炼时,粗铜应作电解池的阳极,电解质溶液在电解过程中浓度不变 |
燃料电池能量利用率可高达80%,下列说法错误的是
| A.燃料电池的负极反应物是氢气、甲烷、乙醇等物质 |
| B.氢氧燃料电池常用于航天飞行器,产物水经过处理之后可供宇航员使用 |
| C.H2SO4作电解质,氢氧燃料电池的负极反应式H2+2OH--2e-=2H2O |
| D.乙醇燃料电池电解质为KOH,负极反应式C2H5OH+16OH--12e-=2CO32-+11H2O |
寒冷的冬天,经常使用暖宝宝,暖宝宝中装的是铁粉、活性炭、无机盐等物质,打开包装以后,可以连续12个小时释放热量,以下分析错误的是
| A.将化学能转化为热能 |
| B.其发热原理与钢铁的吸氧腐蚀相同 |
| C.铁作负极,电极反应为:Fe – 3e → Fe3+ |
| D.活性炭作正极,电极反应为:2H2O + O2 + 4e → 4OH- |
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是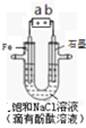
| A.a 为电源的正极 |
| B.通电一段时间后,石墨电极附近溶液先变红 |
| C.Fe电极的电极反应是4OH――4e-=2H2O+O2↑ |
D.电解饱和食盐水的总反应是:2NaCl + 2H2O 2NaOH + H2↑+ Cl2↑ 2NaOH + H2↑+ Cl2↑ |
来自法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小组发明了第一块可为人体人造器官提供电能的可植入的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生的总反应为C6H12O6+6O2=6CO2+6H2O(酸性环境),下列对该电池说法不正确的是
| A.该生物燃料电池不可以在高温下工作 |
| B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+ |
| C.消耗1mol氧气则转移4mole-,H+会向负极移动 |
| D.今后的研究方向是怎样提高葡萄糖生物燃料电池的效率,从而在将来达到可以利用葡萄糖生物燃料电池为任何可植入医疗设备提供电能 |