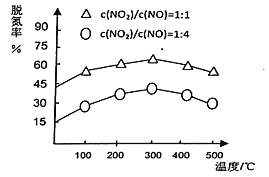
题目内容
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:x A(g)+2B(s)![]() y C(g);△H <0。在一定条件下,容器中 A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g);△H <0。在一定条件下,容器中 A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
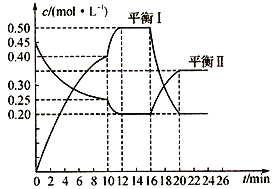
(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)=______________;
(2)根据图示可确定x:y=______________;
(3)0~l0min容器内压强______________(填“变大”,“不变”或“变小”)
(4)推测第l0min引起曲线变化的反应条件可能是______________(填序号);第16min引起曲线变化的反应条件可能是______________(填序号);
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
【答案】 0.02mol/(L·min) 1:2 变大 ④⑥ ④
【解析】(1)0~10min内△c(A)=0.45mol/L-0.25mol/L=0.2mol/L,v(A)=![]() =0.02mol/(Lmin);(2)0~10min内容器中A的物质的量浓度变化为:0.45mol/L-0.25mol/L=0.2mol/L;0~10min内容器中C的物质的量浓度变化为:0.40mol/L,x:y=0.2mol/L:0.40mol/L=1:2;(3)反应前气体物质的量小于反应后气体物质的量,随着反应的进行,气体物质的量增大,气体压强变大;(4)第10min时,单位时间内A、C的物质的量变化量较大,反应速率明显增大,可能为升高温度或者使用催化剂,答案为④⑥;第16min时,C的物质的量减小,A的物质的量增大,说明平衡向逆反应方向移动,该反应为放热反应,应为升高温度,答案为④。
=0.02mol/(Lmin);(2)0~10min内容器中A的物质的量浓度变化为:0.45mol/L-0.25mol/L=0.2mol/L;0~10min内容器中C的物质的量浓度变化为:0.40mol/L,x:y=0.2mol/L:0.40mol/L=1:2;(3)反应前气体物质的量小于反应后气体物质的量,随着反应的进行,气体物质的量增大,气体压强变大;(4)第10min时,单位时间内A、C的物质的量变化量较大,反应速率明显增大,可能为升高温度或者使用催化剂,答案为④⑥;第16min时,C的物质的量减小,A的物质的量增大,说明平衡向逆反应方向移动,该反应为放热反应,应为升高温度,答案为④。

练习册系列答案
相关题目