题目内容
【题目】向 100mL1.5mol/L 的 NaOH 溶液中缓慢通入一定量的 CO2 ,充分反应后,向所得溶液中逐滴缓慢滴加稀盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
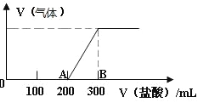
(1)通入一定量的 CO2 充分反应后的溶液中溶质为______(写化学式)
(2)AB 段所发生的离子方程式:______。
(3)滴加稀盐酸的物质的量浓度为______mol/L。
(4)通入二氧化碳的体积为____L(在标准状况下)。
【答案】NaOH 和 Na2CO3 HCO3- + H+ ==== CO2↑ + H2O 0.5 1.12
【解析】
加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→B段发生的反应为NaHCO3+HCl=NaCl+CO2↑+H2O,而O→A段消耗的盐酸是A→B段消耗盐酸的二倍,应为NaOH和Na2CO3的混合物,两者都可以与盐酸发生反应:NaOH+HCl=NaC+H2O、NaHCO3+HCl=NaCl+CO2↑+H2O,根据AB段消耗盐酸的体积,结合方程式计算生成二氧化碳的体积,据此答题。
(1)加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→B段发生的反应为NaHCO3+HCl=NaCl+CO2↑+H2O,而O→A段消耗的盐酸是A→B段消耗盐酸的二倍,应为NaOH和Na2CO3的混合物,故答案为:NaOH和Na2CO3。
(2)A→B段发生的反应为NaHCO3+HCl=NaCl+CO2↑+H2O,离子方程式为:HCO3-+H+=CO2↑+H2O,故答案为:HCO3-+H+=CO2↑+H2O。
(3)B点溶液中的溶质为NaCl,由氯离子守恒可以得知:n(HCl)=n(NaCl)=n(NaOH)=1.5mol/L×0.1L=0.15mol,c(HCl)=n/V=0.15mol/0.3L=0.5mol/L,故答案为:0.5。
(4)AB段消耗盐酸为:0.5mol/L×0.1L=0.05mol,由NaHCO3+HCl=NaCl+CO2↑+H2O可知,生成二氧化碳的物质的量为0.05mol,标况下生成二氧化碳的体积为0.05mol×22.4L/mol=1.12L,根据碳元素守恒,则通入二氧化碳的体积在标准状况下也为1.12L,故答案为:1.12。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】I:已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
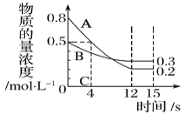
(1)经测定前4 s内v(C)=0.025 mol·L-1·s-1,则该反应的化学方程式为_______________。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 0mol·L-1·s-1; 乙:v(B)=0.10 mol·L-1·s-1; 丙:v(C)=2.4mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______(用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大______(填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_____________ 。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________(填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g) ![]() 2HI(g)已达平衡状态的是________。
2HI(g)已达平衡状态的是________。
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
