题目内容
下列各项中所描述的两个量,前者一定大于后者的是( )
| A、NaCl晶体和晶体NaF的晶格能 | B、等物质的量的CO2分子和分子CH2=CH2中δ键的数目 | C、等物质的量的SO2和O2在一定条件下反应,SO2与O2的转化率 | D、25℃时pH=11的NaOH溶液和pH=11的Na2CO3溶液中的H+的浓度 |
分析:A、离子晶体离子半径越小,电荷越多,离子键越强,晶格能越大.
B、根据单键含有1个δ键,双键含有1个δ键和1个π键分析.
C、根据方程式分析.
D、PH相同,氢离子浓度相同.
B、根据单键含有1个δ键,双键含有1个δ键和1个π键分析.
C、根据方程式分析.
D、PH相同,氢离子浓度相同.
解答:解:A、离子晶体离子半径越小,电荷越多,离子键越强,晶格能越大,NaCl和NaF的离子所带电荷相同,氯离子半径比氟离子大,所以NaCl晶体的晶格能小于NaF的晶格能,故A错误.
B、CO2分子含有2个双键,所以δ键数为2,CH2=CH2中有1个双键和4个单键,所以含有5个δ键,故C错误.
C、已知2SO2+O2?2SO3,等物质的量的SO2和O2在一定条件下反应,消耗的SO2的物质的量是O2的2倍,所以SO2的转化率比O2大,故C正确;
D、PH相同,氢离子浓度相同,所以25℃时pH=11的NaOH溶液和pH=11的Na2CO3溶液中的H+的浓度相同,故D错误;
故选C.
B、CO2分子含有2个双键,所以δ键数为2,CH2=CH2中有1个双键和4个单键,所以含有5个δ键,故C错误.
C、已知2SO2+O2?2SO3,等物质的量的SO2和O2在一定条件下反应,消耗的SO2的物质的量是O2的2倍,所以SO2的转化率比O2大,故C正确;
D、PH相同,氢离子浓度相同,所以25℃时pH=11的NaOH溶液和pH=11的Na2CO3溶液中的H+的浓度相同,故D错误;
故选C.
点评:本题考查较为综合,涉及晶格能比较、δ键的判断、转化率等知识,题目难度中等,注意把握比较的方法和角度,注意影响晶格能的因素.

练习册系列答案
相关题目
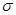 键的数目
键的数目