题目内容
【题目】某试液中只可能含有K+、NH4+、Fe2+、A13+、Cl-、SO42-、CO32-、A1O2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验: 下列说法正确的是
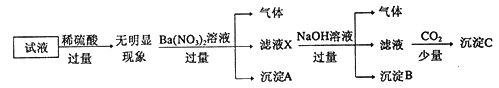
A. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 无法确定原试液中是否含有Al3+、Cl-
【答案】A
【解析】加入过量稀硫酸无明显变化,说明不含碳酸根离子,不含Ba2+,不含AlO2-;加入硝酸钡有气体生成,因为前面已经加入了硫酸,硝酸根离子在酸性条件下具有强氧化性,说明有亚铁离子存在且被氧化,沉淀为硫酸钡;加入NaOH有气体,说明存在铵根离子,生成的气体为氨气,沉淀B为红褐色氢氧化铁沉淀;通入CO2产生沉淀,说明存在Al3+,沉淀C为氢氧化铝。因为存在的离子浓度均为0.1molL-1,从电荷的角度出发,只能含有NH4+、Fe2+、Cl-、SO42-才能保证电荷守恒,K+必然不能存在。故A、原溶液中存在Al3+、NH4+、Fe2+、Cl-、SO42-,选项A正确;B、滤液X中大量存在的阳离子有NH4+、Fe2+和Al3+,选项B错误;C、沉淀C为氢氧化铝,选项C错误;D、原试液中含有Al3+、Cl-,选项D错误。答案选A。

【题目】下列实验操作正确且能达到相应实验目的的是
选项 | 实验目的 | 实验操作 |
A | 配制FeCl3溶液 | 将FeCl3固体溶解于适量蒸馏水 |
B | 称取2.0gNaOH 固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g 砝码,左盘上添加NaOH 固体 |
C | 检验溶液中是否含有NH4+ | 取少最试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
D | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
A. A B. B C. C D. D