题目内容
【题目】①~⑧是元素周期表中前四周期的8种元素,其相对位置如图所示. 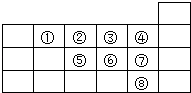
(1)在8种元素中:非金属性最强的元素位于周期表第周期族;最高价氧化物的水化物酸性最强的是(填化学式).
(2)⑤、⑥、⑦三种元素的简单氢化物中稳定性最差的是(填化学式);⑥的阴离子结构示意图为 .
(3)②与③形成的化合物是常见的大气污染物之一,可用②的简单氢化物在催化剂及加热条件下还原
为无害气体,该反应的化学方程式为 .
(4)能说明⑧的非金属性比⑥的强的化学方程式为(举1例).
(5)由①、②、③三种元素可形成一种摩尔质量为84gmol﹣1的分子X,且X中三种元素的原子数目之比为1:1:1.已知X分子中各原子均达到8电子稳定结构,且分子中无双键,画出X分子的结构式: .
【答案】
(1)二;Ⅶ A;HClO4
(2)PH3;![]()
(3)4NH3+6NO ![]() 5N2+6H2O和8NH3+6NO2
5N2+6H2O和8NH3+6NO2 ![]() 7N2+12H2O
7N2+12H2O
(4)H2S+Br2=2HBr+S↓(或Na2S+Br2=2NaBr+S↓)
(5)N≡C﹣O﹣O﹣C≡N
【解析】解:(1)在8种元素中:非金属性最强的元素是F,位于周期表第二周期,第ⅦA 族;最高价氧化物的水化物酸性最强的是高氯酸,化学式为:HClO4 , 所以答案是:二;ⅦA;HClO4;(2)⑤P、⑥S、⑦Cl非金属性最差的是磷,所以磷化氢的稳定性最差,硫离子的结构示意图为 ![]() ,所以答案是:PH3;
,所以答案是:PH3; ![]() ;(3)氮与氧形成常见的染污物是一氧化氮和二氧化氮,与氨气反应的化学方程式分别为:4NH3+6NO
;(3)氮与氧形成常见的染污物是一氧化氮和二氧化氮,与氨气反应的化学方程式分别为:4NH3+6NO ![]() 5N2+6H2O和8NH3+6NO2
5N2+6H2O和8NH3+6NO2 ![]() 7N2+12H2O,所以答案是:4NH3+6NO
7N2+12H2O,所以答案是:4NH3+6NO ![]() 5N2+6H2O和8NH3+6NO2
5N2+6H2O和8NH3+6NO2 ![]() 7N2+12H2O;(4)单质间的置换反应能确定氧化性强弱,可以用H2S+Br2=2HBr+S↓(或Na2S+Br2=2NaBr+S↓),说明溴的非金属性强于硫,所以答案是:H2S+Br2=2HBr+S↓(或Na2S+Br2=2NaBr+S↓);(5)X中三种元素的原子数目之比为1:1:1,设分子式为:(CON)x , 则x=
7N2+12H2O;(4)单质间的置换反应能确定氧化性强弱,可以用H2S+Br2=2HBr+S↓(或Na2S+Br2=2NaBr+S↓),说明溴的非金属性强于硫,所以答案是:H2S+Br2=2HBr+S↓(或Na2S+Br2=2NaBr+S↓);(5)X中三种元素的原子数目之比为1:1:1,设分子式为:(CON)x , 则x= ![]() =2,所以分子式为:(CON)2 , 各原子均达到8电子稳定结构,且分子中无双键,所以结构式为:N≡C﹣O﹣O﹣C≡N,所以答案是:N≡C﹣O﹣O﹣C≡N.
=2,所以分子式为:(CON)2 , 各原子均达到8电子稳定结构,且分子中无双键,所以结构式为:N≡C﹣O﹣O﹣C≡N,所以答案是:N≡C﹣O﹣O﹣C≡N.

