题目内容
【题目】25℃ 时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( ) 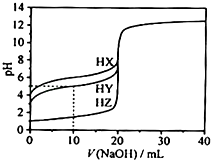
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10﹣5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X﹣)>c(Y﹣)>c(OH﹣)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)═ ![]() +c(Z﹣)+c(OH﹣)
+c(Z﹣)+c(OH﹣)
【答案】B
【解析】解:A、氢氧化钠体积为0时,0.1000molL﹣1的三种酸HX、HY、HZ的pH分别为4、3、1,故酸性大小为:HX<HY<HZ,所以相同条件下导电性大小为:HZ>HY>HX,故A错误; B、当NaOH溶液滴到10mL时,溶质为等物质的量的NaA、HA,则溶液中c(HY)≈c(Y﹣),HA的电离平衡常数Ka(HY)= ![]() ≈c(H+)=10﹣PH=10﹣5 , 故B正确;
≈c(H+)=10﹣PH=10﹣5 , 故B正确;
C、HX恰好完全反应时,HY早已经完全反应,所得溶液为NaX和NaY混合液,酸性HX<HY,NaY水解程度小于NaX,则溶液中c(X﹣)<c(Y﹣),所以溶液中离子浓度大小关系为:c(Y﹣)>c(X﹣)>c(OH﹣)>c(H+),故C错误;
D、HY与HZ混合,溶液中电荷守恒为:c(H+)=c(Y﹣)+c(Z﹣)+c(OH﹣);HA的电离平衡常数为Ka(HY)= ![]() ,c(Y﹣)=
,c(Y﹣)= ![]() ,c(H+)=
,c(H+)= ![]() +c(Z﹣)+c(OH﹣),故D错误;
+c(Z﹣)+c(OH﹣),故D错误;
故选B.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目