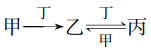题目内容
【题目】Ⅰ.(1)当1 g氨气完全分解为N2和H2时,吸收2.7kJ的热量,写出其热化学方程式:___________________________________________________________。
(2)HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和NaOH反应的中和热的热化学方程式为____________________________________________。
Ⅱ.已知下列反应,回答下列问题:
2CO(g)+O2(g)=2CO2(g) △H=﹣566kJ/mol ①
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g) △H=﹣266kJ/mol ②
O2(g) △H=﹣266kJ/mol ②
(1)CO的燃烧热为______________。
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:______________________________________________________________。
(3)已知反应①中的相关的化学键键能数据如下:则a=____________ kJ/mol
化学键 | C=O(CO2) | C | O=O |
E/(kJ.mol-1) | 803.5 | 1076 | a |
【答案】 2NH3(g)![]() N2(g)+3H2(g) ΔH=+91.8kJ/mol
N2(g)+3H2(g) ΔH=+91.8kJ/mol ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol 283kJ/mol CO(g)+Na2O2(s)=Na2CO3(s) △H=﹣549 kJ/mol 496
Na2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol 283kJ/mol CO(g)+Na2O2(s)=Na2CO3(s) △H=﹣549 kJ/mol 496
【解析】(1)n(NH3)=1g/7g/mol=1/17mol,,则分解1molNH3吸收17×2.72kJ=46.24kJ能量,生成1molNH3放出46.24kJ能量,则其热化学方程式:
2NH3(g)![]() N2(g)+3H2(g) ΔH=+91.8kJ/mol;
N2(g)+3H2(g) ΔH=+91.8kJ/mol;
(2)H2SO4和NaOH反应本质就是氢离子与氢氧根离子生成水,与HCl和NaOH反应一样,则它们的中和热一样,则H2SO4和NaOH反应的中和热的热化学方程式为:
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol;
Na2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol;
Ⅱ.(1) 由燃烧热定义和2CO(g)+O2(g)=2CO2(g) △H=﹣566kJ/mol可知,1molCO完全燃烧放出的热量即283kJ/mol;
(2)由盖斯定律可知,一氧化碳可与过氧化钠反应生成固体碳酸钠的热效应为①/2+②,
△H=﹣566kJ/mol/2+(﹣266kJ/mol)=﹣549 kJ/mol,热化学方程式为:
CO(g)+Na2O2(s)=Na2CO3(s) △H=﹣549 kJ/mol;
(3)反应热与键能的公式:反应热= 旧化学键的键能之和—新化学键的键能之和;
ΔH =1076 kJ/mol×2+ a —803.5 kJ/mol×2×2=﹣566kJ/mol,a = 496 kJ/mol。

 综合自测系列答案
综合自测系列答案