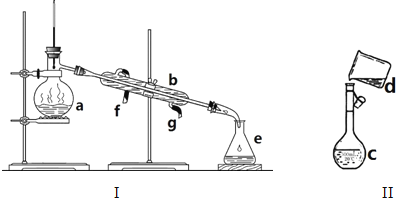
题目内容
【题目】有一块铁的“氧化物”样品,用140mL5.0mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025molCl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
【答案】D
【解析】试题解析:n (HCl)=0.14L×5.0mol/L=0.7mol,由氧化物和盐酸反应生成水可知,氧化物中含有n(O)=![]() n(HCl)=0.35mol,
n(HCl)=0.35mol,
所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,反应后所得溶液为FeCl3,因n(Cl-)=0.7mol+0.025mol×2=0.75mol,则n(Fe3+)=![]() n(Cl-)=0.25mol,所以氧化物中n(Fe):n(O)=0.25:0.35=5:7,
n(Cl-)=0.25mol,所以氧化物中n(Fe):n(O)=0.25:0.35=5:7,
所以化学式为Fe5O7,选D.

【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
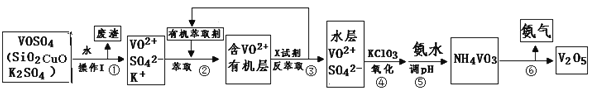
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+ 2nHA(有机层)![]() 2RAn(有机层)+ nH2SO4(水层)
2RAn(有机层)+ nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 0 | 1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有 和 。