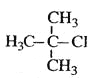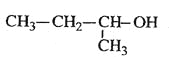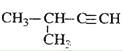题目内容
【题目】Fe、Co、Ni是三种重要的金属元素。回答下列问题:
(1)Fe、Co、Ni在周期表中的位置为_________,基态Fe原子的电子排布式为__________。
(2)CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA,则CoO晶体的密度为______g﹒cm-3:三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为_______。

(3)Fe、Co、Ni能与C12反应,其中Co和为Ni均生产二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为____,Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:______。
(4)95℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图所示,当![]() 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为_____。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为______(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为_______。
大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为_____。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为______(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为_______。

【答案】第四周期第VIII族 1s22s22p63s23p63d64s2或[Ar]3d64s2 ![]() NiO>CoO>FeO CoCl3>Cl2>FeCl3 2Co(OH)3 +6H+ +2Cl-=Cl2↑+2Co2++6H2O 随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜 少量多次 3Ni +3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3=NiSO4+2NO2↑+2H2O
NiO>CoO>FeO CoCl3>Cl2>FeCl3 2Co(OH)3 +6H+ +2Cl-=Cl2↑+2Co2++6H2O 随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜 少量多次 3Ni +3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3=NiSO4+2NO2↑+2H2O
【解析】
(1)根据Fe、Co、Ni的原子序数得出位置和基态Fe原子的电子排布式。
(2)根据晶胞结构计算出O2和Co2+个数,根据密度公式计算;根据离子晶体键能和晶格能比较熔点。
(3)根据反应方程式氧化剂的氧化性大于氧化产物氧化性,Co(OH)3与盐酸反应发生氧化还原反应生成Cl2、CoCl2、H2O。
(4)类比Fe在常温下与浓硫酸发生钝化,根据图中信息得出原因;根据为了提高产物的纯度,根据Ni与H2SO4反应很慢,而与稀硝酸反应很快这个信息得出添加硝酸的方法和反应方程式。
(1)Fe、Co、Ni分别为26、27、28号元素,它们在周期表中的位置为第四周期第VIII族,基态Fe原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2;故答案为:第四周期第VIII族;1s22s22p63s23p63d64s2或[Ar]3d64s2;。
(2)CoO的面心立方晶胞如图1所示。根据晶胞结构计算出O2个数为![]() ,Co2+个数为
,Co2+个数为![]() ,设阿伏加德罗常数的值为NA,则CoO晶体的密度为
,设阿伏加德罗常数的值为NA,则CoO晶体的密度为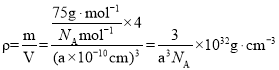 ;三种元素二价氧化物的晶胞类型相同,离子半径Fe2+>Co2+>Ni2+,NiO、CoO、FeO,离子键键长越来越长,键能越来越小,晶格能按NiO、CoO、FeO依次减小,因此其熔点由高到低的顺序为NiO>CoO>FeO;故答案为:
;三种元素二价氧化物的晶胞类型相同,离子半径Fe2+>Co2+>Ni2+,NiO、CoO、FeO,离子键键长越来越长,键能越来越小,晶格能按NiO、CoO、FeO依次减小,因此其熔点由高到低的顺序为NiO>CoO>FeO;故答案为:![]() ;NiO>CoO>FeO。
;NiO>CoO>FeO。
(3)Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生产二氯化物,根据铁和氯气反应生成FeCl3,氧化剂的氧化性大于氧化产物氧化性,因此氧化性:Cl2>FeCl3,氯气与Co和为Ni均生产二氯化物,说明氯气的氧化性比CoCl3弱,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为CoCl3>Cl2>FeCl3,Co(OH)3与盐酸反应有黄绿色气体生成,发生氧化还原反应生成Cl2、CoCl2、H2O,其离子方程式:2Co(OH)3+6H++2Cl-=Cl2↑+2Co2++6H2O;故答案为:CoCl3>Cl2>FeCl3;2Co(OH)3 +6H+ +2Cl-=Cl2↑+2Co2++6H2O。
(4)类比Fe在常温下与浓硫酸发生钝化,根据图中信息,当![]() 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜。工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,根据Ni与H2SO4反应很慢,而与稀硝酸反应很快,因此在硫酸中少量多次添加HNO3的方式来提高反应速率,反应生成NiSO4、H2O,根据硝酸浓度不同得到NO或NO2,此法制备NiSO4的化学方程式为3Ni+3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3 =NiSO4+2NO2↑+2H2O;故答案为:随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜;少量多次;3Ni +3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3=NiSO4+2NO2↑+2H2O。
大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜。工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,根据Ni与H2SO4反应很慢,而与稀硝酸反应很快,因此在硫酸中少量多次添加HNO3的方式来提高反应速率,反应生成NiSO4、H2O,根据硝酸浓度不同得到NO或NO2,此法制备NiSO4的化学方程式为3Ni+3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3 =NiSO4+2NO2↑+2H2O;故答案为:随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜;少量多次;3Ni +3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3=NiSO4+2NO2↑+2H2O。