题目内容
11.A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,甲、乙、丙为常见化合物.它们之间有如下转化关系: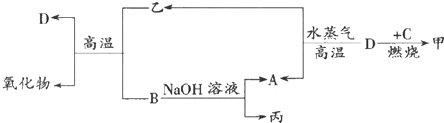
(1)乙与B的反应在工业上俗称铝热反应,C电子式为
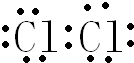 .
.(2)D与水蒸汽反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(3)甲的水溶液显酸性(填“酸”或“碱”),原因是(用离子方程式表示)Fe3++3H2O
 Fe(OH)3+3H+.
Fe(OH)3+3H+.
分析 A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,甲、乙、丙为常见化合物,根据转化关系,B与乙反应在高温下发生置换反应生成一氧化物和D,且B能与氢氧化钠反应,则应为铝热反应,所以B应为Al,B能与NaOH溶液反应生成A为H2,丙为NaAlO2,D在高温下与水蒸气反应生成氢气和乙,则D应为Fe,则乙为Fe3O4,D在C中燃烧生成甲,C为Cl2,甲为FeCl3,以此解答该题.
解答 解:A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,甲、乙、丙为常见化合物,根据转化关系,B与乙反应在高温下发生置换反应生成一氧化物和D,且B能与氢氧化钠反应,则应为铝热反应,所以B应为Al,B能与NaOH溶液反应生成A为H2,丙为NaAlO2,D在高温下与水蒸气反应生成氢气和乙,则D应为Fe,则乙为Fe3O4,D在C中燃烧生成甲,C为Cl2,甲为FeCl3,
(1)由以上分析可知乙与B的反应在工业上俗称为铝热反应,C为Cl2,C电子式为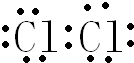 ,
,
故答案为:铝热;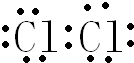 ;
;
(2)D应为Fe,D与水蒸汽反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)甲为FeCl3,由于铁离子水解,所以FeCl3溶液呈酸性,反应的离子方程式为Fe3++3H2O Fe(OH)3+3H+,
Fe(OH)3+3H+,
故答案为:酸;Fe3++3H2O Fe(OH)3+3H+.
Fe(OH)3+3H+.
点评 本题考查无机物的推断,难度中等,反应中特殊转化关系为解答该题的突破口,掌握相关物质的性质,学习中注意先关基础知识的积累.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
1.下列几种说法中正确的有( )
①用试管加热碳酸氢钠固体时使试管口竖直向上
②稀硝酸可除去试管内壁的银镜
③将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu
④蛋白质、乙酸和葡萄糖均属电解质
⑤制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片
⑥用硫酸清洗锅炉中的水垢
⑦H2、SO2、CO2三种气体都可用浓硫酸干燥
⑧用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+.
①用试管加热碳酸氢钠固体时使试管口竖直向上
②稀硝酸可除去试管内壁的银镜
③将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu
④蛋白质、乙酸和葡萄糖均属电解质
⑤制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片
⑥用硫酸清洗锅炉中的水垢
⑦H2、SO2、CO2三种气体都可用浓硫酸干燥
⑧用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+.
| A. | ①③⑤⑦ | B. | ②④⑥⑧ | C. | ②⑤⑦⑧ | D. | ①③④⑥ |
2.下列微粒只具有还原性的是( )
| A. | Fe | B. | Fe2+ | C. | H+ | D. | Cl2 |
19.下列说法正确的是( )
| A. | 非金属不可能形成阳离子 | B. | 两种酸溶液混合不可能呈中性 | ||
| C. | 中和反应一定是放热反应 | D. | 金属不可能形成阴离子 |
6.下列比较、归纳一定正确的是( )
| A. | 酸性:HClO4>H2CO3>H2SiO3 | B. | 稳定性:HF<H2O<NH3 | ||
| C. | 离子半径:Na+>F->Al3+ | D. | 沸点:HI>HBr>HF |
3.取0.2mol MnO2固体粉末与一定体积的浓盐酸(含溶质0.4mol)共热制取氯气(假设HCl挥发损失不计),下列叙述中正确的是( )
| A. | 反应过程中MnO2作催化剂 | B. | 盐酸未反应完 | ||
| C. | 被还原的HCl少于0.2mol | D. | 反应产生2.24L氯气(标准状况) |
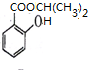
 +3NaOH$\stackrel{水}{→}$
+3NaOH$\stackrel{水}{→}$ +CH3COONa+2H2O
+CH3COONa+2H2O