题目内容
在含有agHNO3的稀硝酸中,加入bg铁粉恰好完全反应.若生成的气体只有NO,且有
gHNO3被还原,则a:b不可能的是( )
| a |
| 4 |
分析:硝酸具有强氧化性,铁具有还原性,铁粉反应可能生成Fe2+或Fe3+或Fe2+与Fe3+,
推论计算:
(1)恰好反应,铁被氧化成Fe3+,根据电子转移守恒计算a:b;
(2)恰好反应,铁被氧化成Fe2+,根据电子转移守恒计算a:b;
(3)恰好反应,铁被氧化成Fe2+与Fe3+,根据(1)、(2)的极限可知,该a:b介于上述两种情况之间.
推论计算:
(1)恰好反应,铁被氧化成Fe3+,根据电子转移守恒计算a:b;
(2)恰好反应,铁被氧化成Fe2+,根据电子转移守恒计算a:b;
(3)恰好反应,铁被氧化成Fe2+与Fe3+,根据(1)、(2)的极限可知,该a:b介于上述两种情况之间.
解答:解:n(Fe)=
mol,n(HNO3)=
mol,故n(NO)=
×
mol,
(1)恰好反应,铁被氧化成Fe3+,根据电子转移守恒:3×
mol=
×
mol×(5-2),整理得:a:b=9:2;
(2)恰好反应,铁被氧化成Fe2+,根据电子转移守恒:2×
mol=
×
mol×(5-2),整理得:a:b=3:1;
(3)恰好反应,铁被氧化成Fe2+与Fe3+,根据(1)、(2)的极限可知,该a:b介于上述两种情况之间,故:
3:1<a:b<9:2,
综上所述,a:b=2:1不可能,故选A.
| b |
| 56 |
| a |
| 63 |
| 1 |
| 4 |
| a |
| 63 |
(1)恰好反应,铁被氧化成Fe3+,根据电子转移守恒:3×
| b |
| 56 |
| 1 |
| 4 |
| a |
| 63 |
(2)恰好反应,铁被氧化成Fe2+,根据电子转移守恒:2×
| b |
| 56 |
| 1 |
| 4 |
| a |
| 63 |
(3)恰好反应,铁被氧化成Fe2+与Fe3+,根据(1)、(2)的极限可知,该a:b介于上述两种情况之间,故:
3:1<a:b<9:2,
综上所述,a:b=2:1不可能,故选A.
点评:本题考查氧化还原反应的计算,难度中等,关键是判断铁的氧化产物,再根据电子转移守恒计算,注意讨论法与极限法的利用.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
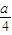 gHNO3被还原,则a:b不可能的是( )
gHNO3被还原,则a:b不可能的是( )