题目内容
下列实验不能达到预期目的的是:( )
| 序号 | 实验操作 | 实验目的 |
| A | 取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊 | 确定NaHCO3溶液中是否混有Na2CO3 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 测定等浓度的HCl、HNO3两溶液的pH | 比较氯、N的非金属性强弱 |
| D | 将充满NO2的密闭玻璃球浸泡在热水中 | 研究温度对化学平衡移动的影响 |
AC
解析试题分析:氢氧化钙和碳酸氢钠同样能反应生成白色碳酸钙沉淀,因此不能用于鉴别是否含有碳酸钠,A错误;B项的操作是沉淀的转化实验,白色沉淀转化为黑色沉淀,B正确;比较元素的非金属性,应该通过比较最高价氧化物对应水化物的酸性强弱来决定,C错误;D中NO2气体是红棕色的,通过热水浴加热可以从颜色判断NO2的浓度增大还是减小来判断化学平衡的移动,D正确;故选AC。
考点:本题考查的是离子的检验、沉淀转化、元素非金属性比较、平衡移动等实验的内容。

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
下列根据实验操作和现象得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某钠盐溶液滴入AgNO3溶液 | 有白色沉淀 | 该钠盐不一定是NaCl |
| B | 浓硫酸与NaCl固体混合加热 | 有气体产生 | 硫酸的酸性比HCl强 |
| C | 某无色气体通入溴水中 | 溴水褪色 | 该气体一定是C2H4 |
| D | 向浓度均为0.1mol·L—1的NaCl和NaI混合溶液中滴加少量的Pb(NO3)2溶液 | 出现黄色沉淀 (PbI2) | KSP(PbI2)<KSP(PbCl2) |
下列实验操作正确且能达到预期目的的是
| 选项 | 实验目的 | 操作 |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液 |
| C | 比较盐酸与醋酸的酸性强弱 | 分别测定同温同浓度NaCl与CH3COONa溶液的pH |
| D | 除去苯中混有的苯酚 | 向混合液中加入过量浓溴水,充分反应后,过滤 |
下列实验不能达到目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 向5 mL 0.1 mol/L AgNO3溶液中滴加3滴0.1 mol/L NaCl溶液,产生白色沉淀;再向其中滴加3滴0.1 mol/L的KI溶液,有黄色沉淀产生 | 验证Ksp(AgCl)> Ksp(AgI) |
| B | 向适量样品溶液中滴加KSCN溶液 | 检验FeSO4溶液是否被氧化 |
| C | 向适量样品溶液中滴加盐酸酸化,再滴加BaCl2溶液 | 检验Na2SO3溶液是否被氧化 |
| D | 向Na2SiO3溶液中通入CO2 | 验证非金属性:碳>硅 |
从下列事实所得出的相应结论正确的是( )
| 序号 | 实验事实 | 结论 |
| ① | Cl2的水溶液可以导电 | Cl2是电解质 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| ④ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
A.①② B.②④ C.①③ D.③④
下列根据实验操作和现象所得出的结论正确的是( )
| | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HB酸性比HA强 |
| C | 在镁、铝为电极,氢氧化钠为电解质的原电池装置中 | 镁表面有气泡 | 金属活动性:Al>Mg |
| D | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后加入0.5 mL有机物Y加热 | 未出现砖红色沉淀 | Y中不含有醛基 |
“封管实验”具有简易、方便、节约、绿色等优点,观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是 ( )。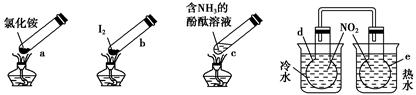
| A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 |
| C.加热时,c中溶液红色变深,冷却后又变浅 |
| D.e内气体颜色变浅,d内气体颜色加深 |
