题目内容
【题目】Ⅰ.硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
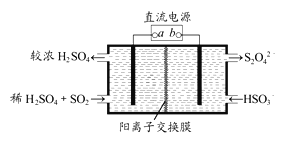
①阳极的电极反应式为__________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为_________。
Ⅱ.乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
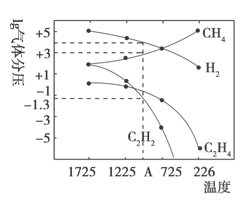
(2)T2℃时,向1L恒容密闭容器中充入0.3molCH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g) ΔH,达到平衡时,测得c(C2H4)= c(CH4)。该反应的ΔH____0(填“>”或“<”),CH4的平衡转化率为_________。上述平衡状态某一时刻,若改变温度至T℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时2c(C2H4) = c(CH4),则t=________s。
C2H4(g)+2H2(g) ΔH,达到平衡时,测得c(C2H4)= c(CH4)。该反应的ΔH____0(填“>”或“<”),CH4的平衡转化率为_________。上述平衡状态某一时刻,若改变温度至T℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时2c(C2H4) = c(CH4),则t=________s。
(3)列式计算反应2CH4(g) =C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=_________(用平衡分压代替平衡浓度计算:lg![]() ≈ -1.3)。
≈ -1.3)。
【答案】 SO2+2H2O-2e-=SO42-+4H+ 1:2 > 66.7% 5 5×104
【解析】(1)①电解池左侧SO2气体进入电解池,最后生成H2SO4,S元素的化合价升高,SO2发生氧化反应,所以左侧电极为电解池的阳极,电极反应式为SO2+2H2O-2e-=SO42-+4H+。②根据前面分析可知右侧为电解池阴极,排出的溶液为S2O42-,碱性下S2O42-与NO2反应生成N2、SO32-等,氧化剂为NO2,还原剂为S2O42-,根据得失电子守恒有4×n(NO2)=1×2×n(S2O42-),所以n(NO2):n(S2O42-)=1:2。
(2)据图可知温度降低时,C2H4的分压减小,即乙烯的物质的量减小,说明2CH4(g)![]() C2H4(g)+2H2(g)的平衡逆向移动,所以逆反应为放热反应,则正反应为吸热反应,所以ΔH>0;设CH4反应的物质的量为x,则生成的乙烯的物质的量为x/2,平衡时CH4的物质的量为0.3-x,则0.3-x=x/2,解得x=0.2mol,所以CH4的平衡转化率为0.2÷0.3×100%=66.7%。平衡时,CH4的浓度为0.1mol/L,C2H4的浓度为0.1mol/L,H2的浓度为0.2mol/L,经过t秒后,CH4的浓度增加0.01tmol /L,C2H4的浓度减小0.005tmol /L,所以t秒后CH4的浓度为(0.1+0.01t)mol /L,C2H4的浓度为(0.1-0.005t)mol /L ,因为2c(C2H4) = c(CH4),所以(0.1-0.005t)×2=(0.1+0.01t),解得t=5。
C2H4(g)+2H2(g)的平衡逆向移动,所以逆反应为放热反应,则正反应为吸热反应,所以ΔH>0;设CH4反应的物质的量为x,则生成的乙烯的物质的量为x/2,平衡时CH4的物质的量为0.3-x,则0.3-x=x/2,解得x=0.2mol,所以CH4的平衡转化率为0.2÷0.3×100%=66.7%。平衡时,CH4的浓度为0.1mol/L,C2H4的浓度为0.1mol/L,H2的浓度为0.2mol/L,经过t秒后,CH4的浓度增加0.01tmol /L,C2H4的浓度减小0.005tmol /L,所以t秒后CH4的浓度为(0.1+0.01t)mol /L,C2H4的浓度为(0.1-0.005t)mol /L ,因为2c(C2H4) = c(CH4),所以(0.1-0.005t)×2=(0.1+0.01t),解得t=5。
(3)用分压代替计算公式中的平衡浓度即可,由图得到lg p(C2H2)=-1.3,所以p(C2H2)=10-1.3=0.05;lg p(H2)=4,所以p(H2)=104;lg p(CH4)=3,所以p(CH4)=103,故K= p(C2H2)×p3(H2)/ p2(CH4)=0.05×1012/106=5×104。

【题目】为探究H2O2制备氧气,生成氧气速率的影响因素,某同学设计了如下一系列实验。
实验编号 | 反应物 | 催化剂 |
甲 | 试管中加入3 mL 2% H2O2溶液和3滴蒸馏水 | 无 |
乙 | 试管中加入3 mL 5% H2O2溶液和3滴蒸馏水 | 无 |
丙 | 试管中加入3 mL 5% H2O2溶液和3滴蒸馏水 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
丁 | 试管中加入3 mL 5% H2O2溶液和3滴稀盐酸溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
戊 | 试管中加入3 mL 5% H2O2溶液和3滴NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
[查阅资料] 过氧化氢(H2O2),其水溶液俗称双氧水,常温下是一种无色液体,性质比较稳定。在加热的条件下,它能分解生成氧气。研究表明,将新制的5%的H2O2溶液加热到65 ℃时就有氧气放出,加热到80 ℃时就有较多氧气产生。
(1)实验丙、实验丁和实验戊的实验目的是_____________________________________。
(2)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的?______
(3)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验丙 | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
实验丁 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
实验戊 | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
①对实验丁,20~40 s的反应速率v1=_____mL·s-1,100~120 s的反应速率v2=_____mL·s-1。不考虑实验测量误差,二者速率存在差异的主要原因是_____________________________________。
②如图是根据实验收集到最大体积的气体时所用时间绘制的图像。曲线c表示的是实验 ______(填“丙”“丁”或“戊”)。



