题目内容
常温下,在10 L容器中通入A mol氢气和B mol氧气(A、B均为小于或等于4的正整数),点燃后充分反应,恢复到常温,容器内的气体(水蒸气的体积忽略不计)密度(g/L)最大值可能是
- A.6.4
- B.9. 6
- C.11.2
- D.12.8
因为密度=气体质量/气体体积,而气体体积恒为10 L,所以所剩的氧气(摩尔质量比氢气大)越多,则最后气体的密度也越大,因此,反应前氧气应尽可能多;氢气则尽可能少,据题意可知,此时氧气的物质的量应为4 mol,氢气的物质的量应为1 mol,则有:
2H2 + O2
 2H2O
2H2O2 1
1 mol 0.5 mol
故,反应后剩余氧气的物质的量为
4 mol-0.5 mol="3.5" mol
此时容器内的气体密度为:
 ="11.2" g·L-1,应选C。
="11.2" g·L-1,应选C。 
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
① 实验2条件下平衡常数K=??????? ??? 。
② 实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③ 实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V正???? V逆(填“<” ,“>” ,“=”)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)?? ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g)?? ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l)?? ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系??????????????? ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为??????? _______________mol/L。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式:????????? 。
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需 时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V正 V逆(填“<” ,“>” ,“=”)。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。
CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 mo1/L 。
A、B、C、D是短周期元素形成的四种气体单质,其它物质为化合物。H常作为普通锌锰干电池的电解质。有关的转化关系如下图所示(反应条件均已略去)。
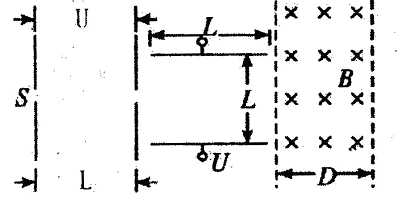
请回答下列问题:
(1)B的结构式为____ ,G的化学式为 。
(2)Y和E在一定条件下可反应生成B和Z,该反应的化学方程式为 。
(3)在体积为0.5L的恒容密闭容器中,充人1.25molB和1.25molD进行如下化学反应:
B(g)+3D(g)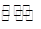 2Y(g),其化学平衡常数K与T的关系如下表所示:
2Y(g),其化学平衡常数K与T的关系如下表所示:
|
T/℃ |
300 |
400 |
|
K |
3.41 |
0.50 |
①若反应在400℃下进行,下列各项中能作为判断该反应达到化学平衡状态依据的是
(填字母)。
A.Y、B、D的物质的量分别为0.50mol、l.0mol、0.50mol
B.v正(B)= 3v 逆(D)
C.容器内压强保持不变
D.混合气体的密度保持不变
②在一定条件下B(g)+3D(g)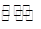 2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
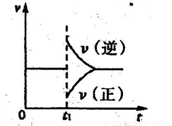
A.维持温度、反应体系体积不变,t1时充入Y(g)
B.维持压强不变,tl时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入Y(g)
(4)0.lmol·L-1的X溶液和0.2mol·L-1的Y溶液等体积混合后显碱性,则该混合溶液中各离子浓度大小顺序是 .
(5)常温下,0.1mol·L-1的Y溶液中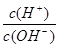 =l×10-8,下列叙述中错误的是 ( )
=l×10-8,下列叙述中错误的是 ( )
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度为0.1mol·L-1
C.该溶液中水电离出的c(H+)与c(OH—)乘积为l×10-22
D.pH=l的X溶液V1L与0.1mol·L-1的Y溶液V2L混合,若混合溶液pH =7,则V1<V2
E.将0.1mol·L-1的Y溶液加水稀释100倍后,pH >9
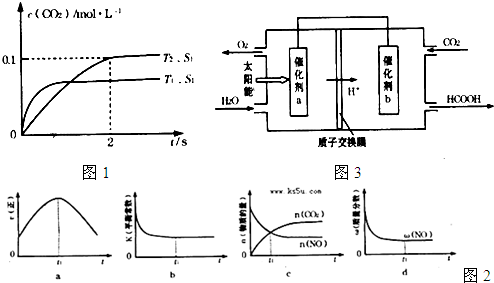

 2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.
2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.