题目内容
8.将图中所示实验装置的K闭合,下列判断正确的是( )
| A. | Zn极上发生还原反应 | |
| B. | 电子沿Zn→a→b→Cu路径流动 | |
| C. | 片刻后,乙池中c(Cu2+)减小,c(SO42-)基本不变,溶液不再保持电中性 | |
| D. | 片刻后可观察到滤纸a点变红色 |
分析 A.由图可知,K闭合时,甲、乙构成原电池,Zn为负极;
B.电子由负极流向正极,电子不能进入溶液中;
C.盐桥中离子可定向移动,中和电荷,溶液仍为电中性;
D.a与电源负极相连为阴极,溶液中氢离子在阴极放电.
解答 解:A.由图可知,K闭合时,甲、乙构成原电池,Zn为负极,失去电子发生氧化反应,故A错误;
B.电子由负极流向正极,电子不能进入溶液中,则电子沿Zn→a,b→Cu路径流动,故B错误;
C.盐桥中离子可定向移动,中和电荷,溶液仍为电中性,乙池中c(Cu2+)减小,c(SO42-)基本不变,故C错误;
D.a与电源负极相连为阴极,溶液中氢离子在阴极放电,则阴极区显碱性,遇酚酞溶液变红,故D正确;
故选D.
点评 本题考查原电池,为高频考点,把握电极、电极反应、电子的移动为解答关键,侧重分析与应用能力的考查,注意电解硫酸钠溶液实质为电解水,选项BC为易错点,题目难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
18.用98%的浓硫酸(密度为1.84g•cm-3)配制 250mL浓度为0.5mol•L-1的H2SO4溶液,选用的仪器正确的是( )
| 选项 | A | B | C | D |
| 仪器及规格 |  100mL量筒 100mL量筒 |  250mL容量瓶 250mL容量瓶 |  托盘天平 托盘天平 |  锥形瓶 锥形瓶 |
| A. | A | B. | B | C. | C | D. | D |
16.化学--我们的生活,我们的未来.下列与生活有关的化学说法错.误.的是( )
| A. | 84消毒液、高温等方法均可有效杀死H7N9禽流感病毒 | |
| B. | 地沟油不可食用,但可以和乙醇反应制备生物柴油 | |
| C. | 化石燃料燃烧产生大量的CO2是造成酸雨的主要原因,酸雨、温室效应和臭氧空洞是世界三大环境问题 | |
| D. | 目前使用的化石能源实际上是地球在远古时代为我们储存的太阳能 |
3.下列说法正确的是( )
| A. | 原子晶体中的相邻原子都以共价键相结合 | |
| B. | 金属晶体的熔点都比分子晶体的熔点高 | |
| C. | 干冰升华时,分子内共价键会发生断裂 | |
| D. | BaO2(过氧化钡)固体中的阴离子和阳离子个数比为2:1 |
5. 25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )
25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )
 25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )
25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )| A. | 曲线上任意一点均存在:c(H+)+c(Na+)═c(OH-)+c(Y2-)+c(HY-) | |
| B. | c(Na+)=0.10 mol•L-1时,溶液中的c(H+)+c(H2Y)═c(OH-)+c(Y2-) | |
| C. | 由图可知,H2Y为二元弱酸,如果将物质的量浓度均为0.20mol•L-1的NaHY和Na2Y溶液等体积混合,所得溶液的pH=4.2 | |
| D. | 已知25℃时,HCOOH的Ka=1×10-4.若把少量H2Y加入到HCOONa溶液中,发生的离子反应可表示为:H2Y+2HCOO-═2HCOOH+Y2- |
2.下列物质对应的电子式书写正确的是( )
| A. | NH4Br: | B. | CaCl2 | ||
| C. |  | D. |  |
1. 最近世界各国都在研究“1C化学”、“2C化学”,它们是以1个或2个碳原子
最近世界各国都在研究“1C化学”、“2C化学”,它们是以1个或2个碳原子
的物质为研究对象,在环境治理和新能源开发等方面有突出贡献.请回答下列问题:
I.汽车尾气中含有CO和NO,某研究小组利用反应:2CO+2NO?N2+2CO2实现气体的无害化排放.T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如表:
(1)0~2s内用N2表示的化学反应速率为1.875×10-4mol/(L•s),该温度下,反应的平衡常数K1=5000L/mol.
(2)若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1>K2(填“>”、“<”或“=”).
Ⅱ.在一定条件下以CO和H2为原料可以合成重要的化工原料乙二醛(OHC-CHO).
(3)CO和H2合成乙二醛的反应为可逆反应,对应的化学方程式为2CO+H2?OHC-CHO.
(4)乙二醛经催化氧化后可得到乙二酸( H2C2O4),H2C2O4是一种二元弱酸,常温下其电离平衡常数K1=5.4×10-2,K2=5.4×10-5则Na HC2O4溶液显酸性(填“酸性”、“中性”或“碱性”);
已知常温下NH3•H2O的电离平衡常数K=1.8×10-5,则反应:NH3•H2O+HC2O4-?NH4++C2O42-的化学平衡
常数K=9.72×104.
(5)工业上用“双极室成对电解法”生产乙醛酸(HOOC-CHO),原理如图所示.该装置中阴、阳两极均为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸,该反应的化学方程式为Cl2+OHC-CHO+H2O═HOOC-CHO+2HCl,N电极的电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O.
 最近世界各国都在研究“1C化学”、“2C化学”,它们是以1个或2个碳原子
最近世界各国都在研究“1C化学”、“2C化学”,它们是以1个或2个碳原子的物质为研究对象,在环境治理和新能源开发等方面有突出贡献.请回答下列问题:
I.汽车尾气中含有CO和NO,某研究小组利用反应:2CO+2NO?N2+2CO2实现气体的无害化排放.T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如表:
| 时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-3mol•L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(2)若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1>K2(填“>”、“<”或“=”).
Ⅱ.在一定条件下以CO和H2为原料可以合成重要的化工原料乙二醛(OHC-CHO).
(3)CO和H2合成乙二醛的反应为可逆反应,对应的化学方程式为2CO+H2?OHC-CHO.
(4)乙二醛经催化氧化后可得到乙二酸( H2C2O4),H2C2O4是一种二元弱酸,常温下其电离平衡常数K1=5.4×10-2,K2=5.4×10-5则Na HC2O4溶液显酸性(填“酸性”、“中性”或“碱性”);
已知常温下NH3•H2O的电离平衡常数K=1.8×10-5,则反应:NH3•H2O+HC2O4-?NH4++C2O42-的化学平衡
常数K=9.72×104.
(5)工业上用“双极室成对电解法”生产乙醛酸(HOOC-CHO),原理如图所示.该装置中阴、阳两极均为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸,该反应的化学方程式为Cl2+OHC-CHO+H2O═HOOC-CHO+2HCl,N电极的电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O.
 . G的一种合成路线如下:
. G的一种合成路线如下:


 ;X生成Y的反应类型是消去反应.
;X生成Y的反应类型是消去反应.
 .
.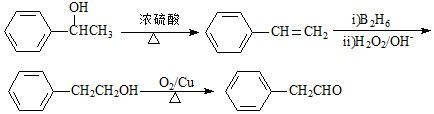 .
.