题目内容
工业上从海水中提取Br2可采用如下方法:
(1)往海水中通入Cl2,将海水中的溴化物氧化,其离子方程式为________。
(2)向上述混合液中吹入热空气,将生成的溴吹出用纯碱溶液吸收,其化学方程式为:________。
(3)将(2)所得溶液用硫酸酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后还可得到副产品Na2SO4,写出这一过程的化学方程式:________。
(4)这样得到的溴中还混有少量Cl2,怎样除去?________。
Cl2 +2Br- = 2Cl- + Br2 3Br2 + 3Na2CO3 = 5NaBr+NaBrO3 + 3CO2↑ 5NaBr+NaBrO3+ 3H2SO4 = 3Br2 + 3Na2SO4+3H2O 加入NaBr
试题分析:(1)氯元素的非金属性强于溴元素的,所以氯气能把溴离子氧化生成单质溴,反应的离子方程式是Cl2 +2Br- = 2Cl- + Br2。
(2)单质溴溶于水显酸性,能和碳酸钠反应放出CO2气体,反应的化学方程式是3Br2 + 3Na2CO3 = 5NaBr+NaBrO3 + 3CO2↑。
(3)根据题意可知,在酸性条件下NaBrO3能把溴化钠氧化生成单质溴,属于同一种元素之间的氧化还原反应,因此反应的化学方程式是5NaBr+NaBrO3+ 3H2SO4 = 3Br2 + 3Na2SO4+3H2O。
(4)根据(1)可知,要除去溴中还混有少量Cl2,可以加入溴化钠即可。
考点:考查卤素单质及其化合物之间的相互转化
点评:该题属于基础性试题,难度不大。主要通过工业上从海水中提取Br2,经验学生对单质溴及其化合物的相互转化熟练掌握程度和有关化学用语的书写。
试题分析:(1)氯元素的非金属性强于溴元素的,所以氯气能把溴离子氧化生成单质溴,反应的离子方程式是Cl2 +2Br- = 2Cl- + Br2。
(2)单质溴溶于水显酸性,能和碳酸钠反应放出CO2气体,反应的化学方程式是3Br2 + 3Na2CO3 = 5NaBr+NaBrO3 + 3CO2↑。
(3)根据题意可知,在酸性条件下NaBrO3能把溴化钠氧化生成单质溴,属于同一种元素之间的氧化还原反应,因此反应的化学方程式是5NaBr+NaBrO3+ 3H2SO4 = 3Br2 + 3Na2SO4+3H2O。
(4)根据(1)可知,要除去溴中还混有少量Cl2,可以加入溴化钠即可。
考点:考查卤素单质及其化合物之间的相互转化
点评:该题属于基础性试题,难度不大。主要通过工业上从海水中提取Br2,经验学生对单质溴及其化合物的相互转化熟练掌握程度和有关化学用语的书写。

练习册系列答案
相关题目
工业上从海水中提取溴的主要反应是:Cl2+2Br-=2Cl-+Br2.下列说法错误的是( )
| A、海水中溴元素主要以形式Br-存在 | B、上述反应属于离子反应 | C、溴单质比氯单质活泼 | D、上述反应属于氧化还原反应 |



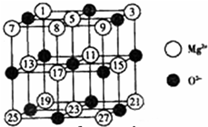 (2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.
(2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.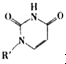 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: