��Ŀ����
����Ŀ���о�̼�������仯�����ת�����ڻ����ĸ������ش����塣
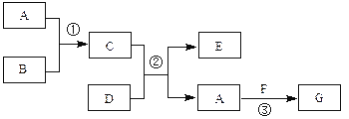
��1��������ԭ������NOx��ת�����£�![]()
��֪��NO(g)+O3(g)=NO2(g)+O2(g) ��H=-200.9kJ/mol
2NO(g)��O2(g)=2NO(g) ��H=-116.2kJ/mol
��ӦI���Ȼ�ѧ����ʽΪ________________��
��2���������뽫CO�����з�Ӧ��ȥ��2CO(g)=2C(s)+O2(g) ��H>0����������������ܷ�ʵ�֣�______����ǡ���) ��������_____________��
��3��һ�������£�CO�����ĩ״�����������������ɼ����ơ���֪����ʱ������ĵ���ƽ�ⳣ��Ka=1.70��10-4��
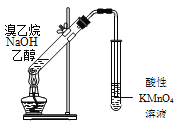
�� �����Ƶ�ˮ��Һ�ʼ��ԣ��������ӷ�Ӧ����ʽ��ʾ��ԭ��___________��
�� ��20mL 0.1mol/L�ļ�������Һ�еμ�10ml 0.1mol/L�����ᣬ���Һ��______�ԣ���ᡱ�������Һ������Ũ�ȴӴ�С��˳��Ϊ______________��
��4������̿Ҳ�����ڴ�������β���е�NO����2L�����ܱ������м���0.1000molNO��2.030mol�������̿������A��B�������壬�ڲ�ͬ�¶��²��ƽ����ϵ�и����ʵ����ʵ������±���
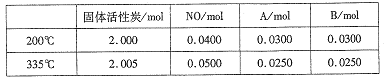
�ٸ÷�Ӧ������ӦΪ________(����ȡ����ȡ�)��Ӧ��
�� 200��ʱ��ƽ���������������ٳ���0.1molNO���ٴ�ƽ���NO�İٷֺ�����_____�������������С�����䡱����
�ۼ��㷴Ӧ��ϵ��335�� ʱ��ƽ�ⳣ��_______��
���𰸡� �� 3NO(g)+O3(g)===3NO2(g) ��H=��317.1 kJ��mol-1
�� �� �÷�Ӧ���������ؼ��ķ�Ӧ,����G=��H -T����S,G>0
�Ǣ�HCOO����H2O![]() HCOOH + OH�� �� �� c (Na+)>c(HCOO��)>c (Cl��)>c(H+)>c(OH-) �Ȣ����� ������ ��0.25
HCOOH + OH�� �� �� c (Na+)>c(HCOO��)>c (Cl��)>c(H+)>c(OH-) �Ȣ����� ������ ��0.25
��������(1)��Ӧ��NO(g)��O3(g)���ݸ�˹���ɣ���NO(g)+O3(g)�TNO2(g)+O2(g)
��H=-200.9kJ/mol����2NO(g)+O2(g)�T2NO(g)��H=-116.2kJ/mol����Ŀ�귴Ӧ�ķ�Ӧ�ȵ��ڢ�+�ڣ�����I���Ȼ�ѧ����ʽΪ3NO(g)+O3(g)�T3NO2(g)��H=-317.1 kJmol-1��
(2)���ݡ�G=��H-T��S�жϷ�Ӧ�ܷ��Է����У������G��0����Ӧ���Է����У���G��0����Ӧ�����Է����У�2CO(g)=2C(s)+O2(g)���÷�Ӧ���������ؼ��ķ�Ӧ������G=��H-T��S��G��0������ʵ�֣�
(3)�ټ�������ǿ�������Σ�ˮ��ʼ��ԣ�����ˮ��Һ�ʼ��ԣ����ӷ�Ӧ����ʽ��ʾ��ԭ��HCOO-+H2O![]() HCOOH+OH-��
HCOOH+OH-��
����20mL 0.1mol/L�ļ�������Һ�еμ�10ml 0.1mol/L�����ᣬ�õ������ʵ���Ũ�ȵļ��ᡢ�����ƺ��Ȼ��ƵĻ��Һ���Լ���ĵ���Ϊ������Һ�����ԣ���Һ������Ũ�ȴӴ�С��˳��Ϊc(Na+)��c(HCOO-)��c(Cl-)��c(H+)��c(OH-)��
(4)���¶�����ƽ�������ƶ�����������Ӧ�Ƿ��ȷ�Ӧ��
����200��ʱ�������ʵ�����ϵ��֪����Ӧ����ʽΪ��2NOA+B����������ļ�������ȣ���ƽ���������������ٳ���0.1molNO���൱������ѹǿ��ƽ�ⲻ�ƶ�������NO�İٷֺ��������䣻
��ƽ�ⳣ������ƽ��ʱ�������Ũ����֮�����Ϸ�Ӧ��Ũ����֮��������K= =0.25��
=0.25��