��Ŀ����
����Ŀ��A��B��C��DΪ������̬���ʣ���֪����A��B������һ�������·������Ϸ�Ӧ������ﻹ������B�������ɺ���ɫ���壻��C�ֱ���A��B��Ӧ���ɵ����ֻ���������ж�����10�����ӣ���C��D��Ӧ���ɵĻ�����������ˮ��������Һ�еμ�AgNO3��Һ�����ɰ�ɫ��������ش��������⣺
��1��A���ʵĵ���ʽ�� �� C��D��Ӧ���ɵĻ�����ĵ���ʽ�� ��
��2���������л���������ȶ���ǿ�����ѧʽ����
��3��д��A��B��Ӧ�Ļ�ѧ����ʽ�� ��
��4����Dͨ��B��C��Ӧ���ɵĻ������У�������Ӧ�����ӷ���ʽ�� �� C��D�γɵĻ�������AgNO3��Һ��Ӧ�����ӷ���ʽΪ ��
���𰸡�
��1��![]() ��
��
��2��H2O��NH3
��3��N2+O2 ![]() 2NO
2NO
��4��Cl2+H2O�TH++Cl��+HClO��Ag++Cl���TAgCl��
���������⣺��1�������к�����������ĵ���ʽ�� ![]() ��������������Ӧ����HCl��HCl��������1����ԭ�Ӻ�1����ԭ��ͨ������1�Ե��ӽ�϶��ɵĹ��ۻ����������ʽΪ
��������������Ӧ����HCl��HCl��������1����ԭ�Ӻ�1����ԭ��ͨ������1�Ե��ӽ�϶��ɵĹ��ۻ����������ʽΪ 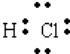 �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
�� 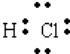 ����2�����л�����ΪNH3��H2O���ǽ�����Խǿ����Ӧ�⻯���ȶ���Խǿ�����ڷǽ����ԣ�N��O�����ȶ��ԣ�H2O��NH3 �� ���Դ��ǣ�H2O��NH3����3��AΪ������BΪO2 �� �ڷŵ������£�������������Ӧ����NO���÷�Ӧ�Ļ�ѧ����ʽΪ��N2+O2
����2�����л�����ΪNH3��H2O���ǽ�����Խǿ����Ӧ�⻯���ȶ���Խǿ�����ڷǽ����ԣ�N��O�����ȶ��ԣ�H2O��NH3 �� ���Դ��ǣ�H2O��NH3����3��AΪ������BΪO2 �� �ڷŵ������£�������������Ӧ����NO���÷�Ӧ�Ļ�ѧ����ʽΪ��N2+O2 ![]() 2NO�����Դ��ǣ�N2+O2
2NO�����Դ��ǣ�N2+O2 ![]() 2NO����4��DΪ������B��C�γɵĻ�����ΪH2O��������ˮ��Ӧ�����Ȼ���ʹ����ᣬ�÷�Ӧ�����ӷ���ʽΪ��Cl2+H2O�TH++Cl��+HClO��C��D�γɵĻ�����ΪHCl��AgNO3��Һ��Ӧ����AgCl�̶ȣ���Ӧ�����ӷ���ʽΪ��Ag++Cl���TAgCl�������Դ��ǣ�Cl2+H2O�TH++Cl��+HClO��Ag++Cl���TAgCl����
2NO����4��DΪ������B��C�γɵĻ�����ΪH2O��������ˮ��Ӧ�����Ȼ���ʹ����ᣬ�÷�Ӧ�����ӷ���ʽΪ��Cl2+H2O�TH++Cl��+HClO��C��D�γɵĻ�����ΪHCl��AgNO3��Һ��Ӧ����AgCl�̶ȣ���Ӧ�����ӷ���ʽΪ��Ag++Cl���TAgCl�������Դ��ǣ�Cl2+H2O�TH++Cl��+HClO��Ag++Cl���TAgCl����

����Ŀ������8��Ԫ�ص����ʡ��������±����У��������ڵڶ���������ڣ�
��� | �� | �� | �� | �� | �� | �� | �� | �� |
ԭ�Ӱ뾶��10��10m�� | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
�����ͻ��ϼ� | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
��2 | ��3 | ��1 | ��3 |
�ش��������⣺
��1���۵�Ԫ�ط����������Ԫ��������������Ԫ�����ڱ��е�λ���ǣ����ڡ��壩�����⻯��ĵ���ʽ�ǣ� ��
��2���ȽϢܺ͢ߵ��⻯����ȶ��ԣ��û�ѧʽ��ʾ�� ��
��3��д���ߵ�����������Ӧˮ����������⻯�ﷴӦ�Ļ�ѧ����ʽ�� ��
