题目内容
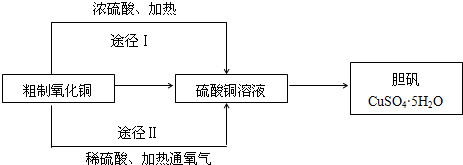
某课外研究小组利用粗制氧化铜(含有少量铜)制取胆矾.他们设计了如下两种不同的制备途径:
(1)途径1中会产生一种污染环境的气体,该气体的化学式是 .
(2)写出途径2中所有反应的化学方程式 ;
(3)金属铜制品长期放置在潮湿的空气中,表面出现一层绿色物质,有关的化学方程式是 .
(4)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 青铜是我国使用最早的合金 | 合金是指多种金属熔合成的金属材料 | Ⅰ错;Ⅱ对;无 |
| B | 精炼铜时,粗铜板作阳极 | 铜具有良好的导电性 | Ⅰ对;Ⅱ对;无 |
| C | 铜锌原电池中,铜是正极 | CuO和Cu2O都是黑色固体 | Ⅰ错;Ⅱ错;无 |
| D | CuO能与水反应生成Cu(OH)2 | 金属氧化物都能与水反应生成相应的金属氢氧化物 | Ⅰ对;Ⅱ对;有 |
【答案】分析:(1)金属铜和浓硫酸反应生成的二氧化硫具有毒性;
(2)氧化铜可以和硫酸反应生成硫酸铜和水,在加热通入氧气的条件下,金属铜可以和硫酸反应;
(3)金属铜制品长期放置在潮湿的空气中,会和空气中的成分发生反应生成铜绿;
(4)A、合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质;
B、精炼铜时,粗铜板作阳极,精铜做阴极;
C、CuO是黑色固体,Cu2O是红色的固体;
D、氧化铜、氧化铝、氧化铁、氧化亚铁等金属氧化物均不溶于水中,不和水发生反应.
解答:解:(1)粗制氧化铜中的金属铜和浓硫酸反应生成会生成二氧化硫,该气体具有毒性,故答案为:SO2;
(2)氧化铜可以和硫酸反应生成硫酸铜和水,即CuO+H2SO4=CuSO4+H2O,在加热通入氧气的条件下,金属铜可以和硫酸反应,实质是:2Cu+O2+2H2SO4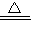 2CuSO4+2H2O,故答案为:2Cu+O2+2H2SO4
2CuSO4+2H2O,故答案为:2Cu+O2+2H2SO4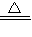 2CuSO4+2H2O,CuO+H2SO4=CuSO4+H2O;
2CuSO4+2H2O,CuO+H2SO4=CuSO4+H2O;
(3)金属铜制品长期放置在潮湿的空气中,会和空气中的二氧化碳、水以及氧气发生反应生成铜绿,
即2Cu+O2+H2O+CO2=Cu2(OH)2CO3,故答案为:2Cu+O2+H2O+CO2=Cu2(OH)2CO3;
(4)A、合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质,不一定是金属和金属的混合物,故A错误;
B、精炼铜时,粗铜板作阳极,精铜做阴极,金属具有导电性,金属铜能导电和电解精炼铜时,粗铜作阳极,精铜做阴极之间没有因果关系,故B正确;
C、CuO是黑色固体,Cu2O是红色的固体,故C错误;
D、氧化铜、氧化铝、氧化铁、氧化亚铁等金属氧化物均不溶于水中,不能和水发生反应得到对应的氢氧化物,故D错误.
故选B.
点评:本题的关键是符合因果关系,考查学生对教材知识的掌握,难度不大.
(2)氧化铜可以和硫酸反应生成硫酸铜和水,在加热通入氧气的条件下,金属铜可以和硫酸反应;
(3)金属铜制品长期放置在潮湿的空气中,会和空气中的成分发生反应生成铜绿;
(4)A、合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质;
B、精炼铜时,粗铜板作阳极,精铜做阴极;
C、CuO是黑色固体,Cu2O是红色的固体;
D、氧化铜、氧化铝、氧化铁、氧化亚铁等金属氧化物均不溶于水中,不和水发生反应.
解答:解:(1)粗制氧化铜中的金属铜和浓硫酸反应生成会生成二氧化硫,该气体具有毒性,故答案为:SO2;
(2)氧化铜可以和硫酸反应生成硫酸铜和水,即CuO+H2SO4=CuSO4+H2O,在加热通入氧气的条件下,金属铜可以和硫酸反应,实质是:2Cu+O2+2H2SO4
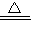 2CuSO4+2H2O,故答案为:2Cu+O2+2H2SO4
2CuSO4+2H2O,故答案为:2Cu+O2+2H2SO4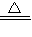 2CuSO4+2H2O,CuO+H2SO4=CuSO4+H2O;
2CuSO4+2H2O,CuO+H2SO4=CuSO4+H2O;(3)金属铜制品长期放置在潮湿的空气中,会和空气中的二氧化碳、水以及氧气发生反应生成铜绿,
即2Cu+O2+H2O+CO2=Cu2(OH)2CO3,故答案为:2Cu+O2+H2O+CO2=Cu2(OH)2CO3;
(4)A、合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质,不一定是金属和金属的混合物,故A错误;
B、精炼铜时,粗铜板作阳极,精铜做阴极,金属具有导电性,金属铜能导电和电解精炼铜时,粗铜作阳极,精铜做阴极之间没有因果关系,故B正确;
C、CuO是黑色固体,Cu2O是红色的固体,故C错误;
D、氧化铜、氧化铝、氧化铁、氧化亚铁等金属氧化物均不溶于水中,不能和水发生反应得到对应的氢氧化物,故D错误.
故选B.
点评:本题的关键是符合因果关系,考查学生对教材知识的掌握,难度不大.

练习册系列答案
相关题目
硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用.某课外研究小组的同学用粗铜粉(含有碳等杂质)设计了两种制备胆矾的途径,并测定了其中结晶水的含量.设计的流程如图1:
(1)“较纯铜”转化为氧化铜时,应将其置于 内进行灼烧(填写仪器名称).“粗铜”表面的油脂可以用热碱溶液洗去,原因是 .若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜.存在少量铜的可能原因是 .
a.灼烧过程中部分氧化铜被还原 b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥.比较由粗制氧化铜制取胆矾的两种途径,途径Ⅰ有明显的两个优点:① ;② .
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是 .
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥
d.加热过程中有少量溅失
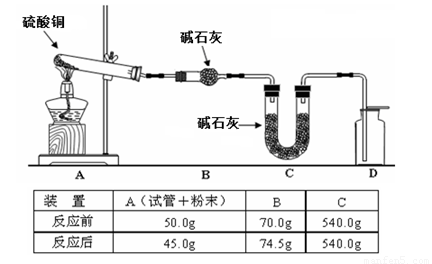
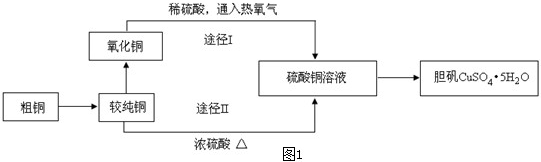
(4)利用如图2装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃.反应前后各装置的质量见表格中所示.
请通过计算,推断该实验条件下硫酸铜分解的化学方程式: .

(1)“较纯铜”转化为氧化铜时,应将其置于
a.灼烧过程中部分氧化铜被还原 b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥
d.加热过程中有少量溅失
(4)利用如图2装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃.反应前后各装置的质量见表格中所示.
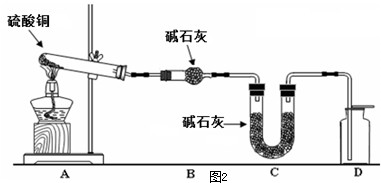
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 50.0g | 70.0g | 540.0g |
| 反应后 | 45.0g | 74.5g | 540.0g |

请通过计算,推断该实验条件下硫酸铜分解的化学方程式:
某课外研究小组利用粗制氧化铜(含有少量铜)制取胆矾.他们设计了如下两种不同的制备途径:
(1)途径1中会产生一种污染环境的气体,该气体的化学式是______.
(2)写出途径2中所有反应的化学方程式______;
(3)金属铜制品长期放置在潮湿的空气中,表面出现一层绿色物质,有关的化学方程式是______.
(4)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是______(填字母).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 青铜是我国使用最早的合金 | 合金是指多种金属熔合成的金属材料 | Ⅰ错;Ⅱ对;无 |
| B | 精炼铜时,粗铜板作阳极 | 铜具有良好的导电性 | Ⅰ对;Ⅱ对;无 |
| C | 铜锌原电池中,铜是正极 | CuO和Cu2O都是黑色固体 | Ⅰ错;Ⅱ错;无 |
| D | CuO能与水反应生成Cu(OH)2 | 金属氧化物都能与水反应生成相应的金属氢氧化物 | Ⅰ对;Ⅱ对;有 |