题目内容
足量的一氧化碳还原14.5 g铁的氧化物的混合物。将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则该混合物的组合不可能是
①Fe2O3、Fe3O4、FeO;②FeO、Fe3O4;③Fe3O4、Fe2O3;④FeO、Fe2O3
A.①② B.②③ C.③④ D.①④
B
【解析】
试题分析:CO还原铁的氧化物生成CO2,CO2与氢氧化钙反应生成碳酸钙,即25g是碳酸钙的质量,物质的量=25g÷100g/mol÷0.25mol。则根据原子守恒可知CO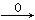 CO2→CaCO3,金属氧化物中氧元素的物质的量是0.25mol,其质量=0.25mol×16g/mol=4g。则金属氧化物中铁元素的质量=14.5g-4g=10.5g,物质的量=105.g÷56g/mol=0.1875mol,所以金属氧化物中铁与氧元素的个数之比=0.1875:0.25=3:4。由于氧化铁与氧化亚铁按照物质的量之比1:1混合即可以满足铁与氧元素的个数之比=3:4,所以选项①、④均有可能,而选项②③不可能满足铁与氧元素的个数之比=3:4,因此正确的答案选B。
CO2→CaCO3,金属氧化物中氧元素的物质的量是0.25mol,其质量=0.25mol×16g/mol=4g。则金属氧化物中铁元素的质量=14.5g-4g=10.5g,物质的量=105.g÷56g/mol=0.1875mol,所以金属氧化物中铁与氧元素的个数之比=0.1875:0.25=3:4。由于氧化铁与氧化亚铁按照物质的量之比1:1混合即可以满足铁与氧元素的个数之比=3:4,所以选项①、④均有可能,而选项②③不可能满足铁与氧元素的个数之比=3:4,因此正确的答案选B。
考点:考查铁氧化物化学式的判断与计算

下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 |
|
|
|
| ① |
| ② |
|
三 | ③ | ④ | ⑤ | ⑥ |
|
| ⑦ | ⑧ |
四 | ⑨ |
|
|
|
|
| ⑩ |
|
(1)在这些元素中,金属性最强的元素是
(2)化学性质最不活泼的元素其原子结构示意图为 ;
(3)元素的最高价氧化物对应的水化物中酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ;
(4)在③~⑦元素中,原子半径最大的是 ,原子半径最小的是 ;
(5)在⑦与⑩的单质中,化学性质较活泼的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): 。