题目内容
【题目】某化学研究性学习小组设想探究铜的常见化学性质,过程设计如下:
[提出猜想]
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价的铜稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它能被氮的某种气态氢化物还原吗?
[实验探究]
Ⅰ.解决问题1:
(1)需用到的药品除铜、铝、1mol/LCuSO4溶液、稀H2SO4外还需___________ (填试剂化学式);
(2)配制1 mol/LCuSO4溶液25mL,选用的仪器除烧杯、天平、玻璃棒、量筒、胶头滴管外,还有_________________(填仪器名称);
(3)为达到目的,你认为应进行哪些相关实验?(实验内容和步骤)
①制备Cu(OH)2; ②_______________________________________________________
Ⅱ.解决问题2的实验步骤和现象如下:取一定量制得的氢氧化铜周体,于坩埚中灼烧,当温度达到80~100℃得到黑色同体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸或盐酸,得到蓝色溶液,同时观察到试管底还有红色固体存在。根据以上实验及现象:
(4)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:_________________________________;
(5)从实验Ⅱ可得出的结论是__________________________________________________________。
Ⅲ.解决问题3:
设计如下装置:(夹持装置未画出)
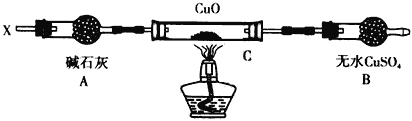
当某种氮的气态氢化物(X)缓缓通过灼热的氧化铜,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入红热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.36 g,并收集到单质气体Y0.28 g;
(6)研究小组同学确证燃烧管生成的红色物质是铜,你认为他们确证的方法是________________;
(7)X气体的摩尔质量为_____________;
(8)C中发生反应的化学方程式:______________________________________________________。
【答案】NaOH溶液250 mL容器瓶将Cu(OH)2分别与稀硫酸、NaOH溶液反应Cu2O+2H+=Cu+Cu2++H2O固体时低温下,Cu2+稳定;1 000℃以上时,Cu+稳定;在酸性环境Cu2+稳定、Cu+不稳定将红色物质置于稀硫酸中,若溶液不变蓝,则确定为Cu32g/molN2H4+2CuO![]() 2Cu+N2+2H2O
2Cu+N2+2H2O
【解析】
Ⅰ、(1)探究氢氧化铜是否能和硫酸和氢氧化钠反应的实验来选择药品;(2)配制一定物质的量浓度的溶液所需仪器:烧杯、天平、玻璃棒、量筒、胶头滴管、一定体积的容量瓶;(3)氢氧化铜是否能和硫酸和氢氧化钠反应的实验中,首先是氢氧化铜的配制,然后是让氢氧化铜和硫酸以及氢氧化钠反应;Ⅱ、(4)氧化亚铜与稀硫酸(或盐酸)反应生成金属单质铜和二价铜离子的盐溶液;(5)根据溶液中的离子反应来确定稳定存在的离子;Ⅲ、(6)根据金属铜和氧化亚铜的性质区别来回答;(8)根据原子守恒确定气态氢化物的化学式,并根据实验现象来书写化学方程式。
Ⅰ、(1)探究氢氧化铜是否能和硫酸和氢氧化钠反应的实验需要的药品是:制取氢氧化铜的硫酸铜和氢氧化钠,验证试验用到硫酸和氢氧化钠,所以需要硫酸铜和氢氧化钠以及硫酸溶液;(2)配制一定物质的量浓度的溶液所需仪器:烧杯、天平、玻璃棒、量筒、胶头滴管、一定体积的容量瓶,容量瓶的规格根据所配置的溶液来确定,故答案为:250mL容量瓶;(3)氢氧化铜是否能和硫酸和氢氧化钠反应的实验中,首先是氢氧化铜的配制,然后是让氢氧化铜和硫酸以及氢氧化钠反应,所以实验步骤第一步是:用CuSO4溶液和NaOH溶液制Cu(OH)2;第二步是:将Cu(OH)2分别与稀H2SO4和NaOH溶液反应,故答案为:将Cu(OH)2分别与稀H2SO4和NaOH溶液反应;Ⅱ、(4)氧化亚铜与稀硫酸(或盐酸)反应生成金属单质铜和二价铜离子的盐溶液,反应实质是:Cu2O+2H+=Cu+Cu2++H2O;(5)根据溶液中的离子反应Cu2O+2H+=Cu+Cu2++H2O 可以知道在溶液中Cu2+的稳定性强于Cu+,故从实验Ⅱ可得出的结论是:固体时低温下,Cu2+稳定;1 000℃以上时,Cu+稳定;在酸性环境Cu2+稳定、Cu+不稳定;Ⅲ、(6)金属铜不能和稀硫酸反应,氧化亚铜能和稀硫酸反应,生成硫酸铜蓝色溶液,故答案为:将红色物质置于稀硫酸中,溶液不变蓝,则证明为铜;(7)消耗0.01mol X,测得B装置增重0.36g,即生成0.02mol的水,并收集到单质气体Y 0.28g即氮气0.01mol,根据原子守恒可以确定气态氢化物X中含有4个氢原子和2个氮原子,X的化学式为N2H4,摩尔质量为32g/mol;(8)C中发生反应是N2H4和氧化铜反应生成铜、氮气和水,反应的化学方程式为:N2H4+2CuO![]() 2Cu+N2+2H2O。
2Cu+N2+2H2O。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案