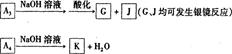题目内容
将容积为50 mL的量筒内充满NO2和O2的混合气体,倒置量筒在盛满水的水槽里,足够时间后,量筒里剩余气体体积为5 mL。则混合气体中NO2和O2体积比可能是__________。
18∶7或43∶7
二氧化氮、氧气混合气体倒置于水中,最后残留气体可能有两种情况:一是氧气,二是一氧化氮。所以应先假设,再列式计算。
(1)若剩余的5 mL气体是O2,则共有45 mL NO2、O2混合气体跟水反应,根据4NO2+?O2+2H2O====4HNO3可得出:
V(NO2)=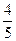 ×45 mL="36" mL
×45 mL="36" mL
V(O2)=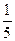 ×45 mL+5 mL="14" mL
×45 mL+5 mL="14" mL
所以,原混合气体中NO2和O2体积比为18∶7。
(2)若剩余的5 mL气体是NO,则NO2、O2混合气体跟水反应时是NO2过量,过量的NO2再跟水反应。根据反应“3NO2+H2O====2HNO3+NO”可得出,共有15 mL NO2过量。
即在NO2、O2混合气体跟水反应的过程中共消耗气体35 mL。根据4NO2+O2+2H2O====4HNO3可得出:
V(O2)=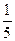 ×35 mL="7" mL
×35 mL="7" mL
V(NO2)=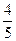 ×35 mL+15 mL="43" mL
×35 mL+15 mL="43" mL
所以,原混合气体中NO2和O2体积比为43∶7。
(1)若剩余的5 mL气体是O2,则共有45 mL NO2、O2混合气体跟水反应,根据4NO2+?O2+2H2O====4HNO3可得出:
V(NO2)=
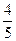 ×45 mL="36" mL
×45 mL="36" mLV(O2)=
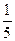 ×45 mL+5 mL="14" mL
×45 mL+5 mL="14" mL所以,原混合气体中NO2和O2体积比为18∶7。
(2)若剩余的5 mL气体是NO,则NO2、O2混合气体跟水反应时是NO2过量,过量的NO2再跟水反应。根据反应“3NO2+H2O====2HNO3+NO”可得出,共有15 mL NO2过量。
即在NO2、O2混合气体跟水反应的过程中共消耗气体35 mL。根据4NO2+O2+2H2O====4HNO3可得出:
V(O2)=
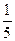 ×35 mL="7" mL
×35 mL="7" mLV(NO2)=
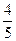 ×35 mL+15 mL="43" mL
×35 mL+15 mL="43" mL所以,原混合气体中NO2和O2体积比为43∶7。

练习册系列答案
相关题目

 氧化成
氧化成 ;③水吸收
;③水吸收