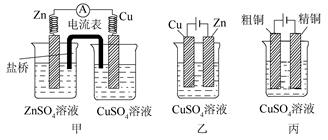
题目内容
下列关于铜的说法正确的是
| A.用电解法精炼粗铜时粗铜作阳极 |
| B.在镀件上镀铜时纯铜作阴极 |
| C.在海轮的外壳上装上铜块可以减缓船体的腐蚀 |
| D.铜的金属活动性比铁弱,因此可用铜罐代替铁罐储运浓硝酸 |
A
解析试题分析:用电解法精炼精铜时,粗铜作阳极,纯铜作阴极,故A正确;根据电镀原理中,镀件作阳极,待镀件置于电解槽的阴极,在镀件上镀铜时纯铜作阳极,B错误,根据活泼性强的金属首先被腐蚀的变化规律,为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌的金属活动性应比铁的活动性强,C错误,金属铁常温下遇到浓硫酸和浓硝酸都会发生钝化,所以铁罐可以储运浓硝酸,但铜在常温下可以和浓硝酸反应,Cu+4HNO3 Cu(NO3)2+2NO2↑+2H2O,所以不能用铜罐代替铁罐储运浓硝酸,D错误。
Cu(NO3)2+2NO2↑+2H2O,所以不能用铜罐代替铁罐储运浓硝酸,D错误。
考点:考查铜的性质,原电池和电解池的工作原理;金属的电化学腐蚀与防护。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
下列各变化中属于原电池反应的是
| A.在空气中金属铝表面迅速氧化形成保护层 |
| B.镀锌铁表面有划损时,也能阻止铁被氧化 |
| C.红热的铁丝与冷水接触,表面形成蓝黑色保护层 |
| D.浓硝酸比稀硝酸更能氧化金属铜 |
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是
| A.乙烧杯中发生还原反应 |
| B.甲烧杯中溶液的pH逐渐减小 |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.外电路的电流方向是从a到b |
将表面发黑(黑色物质为Ag2S)的银器按下图方法处理,一段时间后银器光亮如新。下列说法正确的是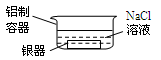
| A.铝质容器为正极,银器为负极 |
| B.反应前后银器质量不变 |
| C.Ag2S被还原生成单质银 |
| D.总反应为2Al+3Ag2S → 6Ag+ Al2S3 |
500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO3-)=0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体1.12 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.原混合溶液中c(Na+)=0.2 mol·L-1 |
| B.电解后溶液中c(H+)=0.2 mol·L-1 |
| C.上述电解过程中共转移0.4mol电子 |
| D.电解后得到的Cu的物质的量为0.1 mol |
有关右图电化学装置的叙述中,正确的是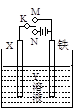
| A.若X为碳棒,Y为饱和食盐水,K置于N,则铁极上析出氯气 |
| B.若X为铂棒,Y为CuCl2溶液,K置于N,则铁棒质量将增加 |
| C.若X为锌棒,Y为海水,K置于M,形成对铁的外加电流阴极保护 |
| D.若X为铜棒,Y为稀硫酸,K置于M,则正极反应为:Fe?2e→Fe2+ |
如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是
| A.逸出气体的体积a电极的小于b电极的 |
| B.一电极逸出无味气体,另一电极逸出刺激性气味气体 |
| C.a电极附近呈红色,b电极附近出现蓝色 |
| D.a电极附近呈蓝色,b电极附近出现红色 |
由铜、锌和稀硫酸组成的原电池中,下列各叙述正确的是( )
| A.溶液中pH由大变小 |
| B.溶液中的SO42-向原电池的正极移动 |
| C.Zn为电池的负极,电极反应:Zn – 2e- ="=" Zn2+ |
| D.在该电池的外电路导线中电子是从铜流向锌 |