题目内容
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如图所示。
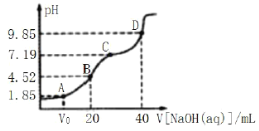
下列说法不正确的是
A. 点A所得溶液中:Vo>10mL
B. 点B所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. 点C所得溶液中:c(Na+)>3c(HSO3-)
D. 点D所得溶液中![]()
【答案】A
【解析】
A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,H2SO3的一级电离平衡常数为Ka1=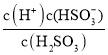 =10-1.85mol/L,c(H+)=Ka1,表明溶液中c(HSO3-)=c(H2SO3),若恰好是10mLNaOH,反应后溶液中c(NaHSO3)=c(H2SO3),因此所加NaOH体积=10mL,故A错误;
=10-1.85mol/L,c(H+)=Ka1,表明溶液中c(HSO3-)=c(H2SO3),若恰好是10mLNaOH,反应后溶液中c(NaHSO3)=c(H2SO3),因此所加NaOH体积=10mL,故A错误;
B.B点是用0.1molL-1NaOH溶液20mL滴定20mL0.1molL-1H2SO3溶液,恰好反应生成NaHSO3,溶液显酸性,溶液中电荷守恒c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-),物料守恒c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),得到:c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故B正确;
C.C点pH=7.19=pKa2,Ka2=![]() =10-7.19,则溶液中c(HSO3-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],因此溶液中c(Na+)>3c(HSO3-),故C正确;
=10-7.19,则溶液中c(HSO3-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],因此溶液中c(Na+)>3c(HSO3-),故C正确;
D.加入氢氧化钠溶液40mL,用0.1mol·L-1NaOH溶液滴定20mL0.1molL-1H2SO3溶液恰好反应生成Na2SO3,即D点溶液中的溶质为Na2SO3,![]() =
=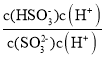 =
=![]() =
=![]() =10-2.66,故D正确;
=10-2.66,故D正确;
故选A。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案