题目内容
【题目】阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )
A.22.4LH2含氢分子数为6.02×1023
B.32gO2中含有的氧原子数为2×6.02×1023
C.0.1mol/L NaCl溶液中,含Na+的数目为6.02×1022
D.标准状况下,22.4L H2O含水分子数为6.02×1023
【答案】B
【解析】A中未指明所处的条件,则22.4L不一定是1mol,故A错误;
B中,N(O)=32g/32g.mol-1×6.02×1023×2,故B正确;
C中溶液体积不知道,则无法求算Na+的数目,故C错误;
标准状况下,H2O为液体,则不能使用Vm,故D错误;

【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。其部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解产生大量白雾 ②易分解:SO2Cl2=SO2↑+Cl2↑ |
回答下列问题:
I.实验室合成硫酰氯需要先制取干燥氯气,制备干燥纯净的氯气所用仪器如下图:
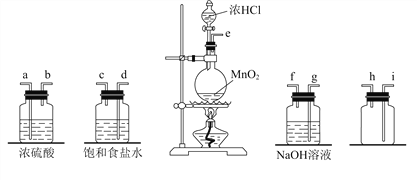
(1)上述仪器的连接顺序是:e接__, 接 , 接 , 接 (按气流方向,用小写字母表示)。
II.催化合成硫酰氯的实验装置如下图 (夹持仪器已省略):
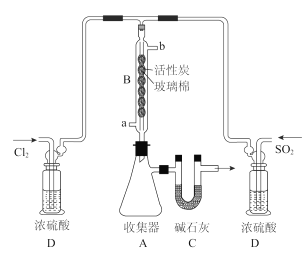
(2)仪器B冷却水的进口为________(填“a””或“b”),活性炭的作用是________。
(3)装置D除干燥气体外,另一作用是_______________。若缺少D,则硫酰氯会水解,该反应的化学方程式为________________。
(4)某同学建议将收集器A放在冰水中冷却,你认为该同学的建议是否合理,为什么?______________________________
(5)C处U形管中碱石灰的作用是__________________________________________。
III.在氯磺酸中加入四氯化锡加热煮沸,使氯磺酸分解,可用于制取少量硫酰氯。化学方程式为:2ClSO3H = H2SO4+SO2Cl2,此法得到的产品中混有硫酸。
(6)①从分解产物中分离出硫酰氯的方法是________。②请设计实验方案检验产品中硫酸的存在(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):________。


