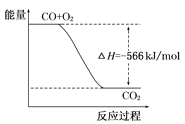
��Ŀ����
����Ŀ����֪�����£�Ũ�Ⱦ�Ϊ0.1 mol��L��1��4��������ҺpH���±�������˵������ȷ����(����)
���� | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
pH | 11.6 | 10.3 | 8.3 | 5.2 |
A. ����SO2ͨ��NaClO��Һ�з�����Ӧ�����ӷ���ʽΪ��H2O��SO2��ClO��===HClO��HSO
B. ����ˮ�м���NaHCO3������������ˮ�д������Ũ��
C. �����£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��Һ��pH������H2SO3
D. NaHSO3��Һ������Ũ�ȴ�С˳��Ϊ��c(Na��)��c(H��)��c(HSO)��c(SO![]() )��c(OH��)
)��c(OH��)
���𰸡�B
��������
���ݱ����ε�pH������ȷ�������ӵ�ˮ��̶���CO32- >ClO- >HCO3- >HSO3-����������˳������HCO3-< HClO <H2CO3<H2SO3,�Դ˷������
A.�������ܽ����������������������A������
B.�����̼�����Ʒ�Ӧ�����Ȼ��ƺͶ�����̼���ٽ�������ˮ��Ӧ���������̼�����Ʋ���Ӧ�����Ե�����Һ�д�����Ũ����������B��ȷ��
C.�������ˮ��̶�Խ�������������Խ�����������ˮ��̶ȴ�С˳������CO32- >ClO- >HCO3- >HSO3-�������ǿ��˳����HCO3-< HClO <H2CO3<H2SO3,���Գ���������ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��Һ��pH������HClO��Һ����C������
D.������������Һ��������˵��HSO3-����̶ȴ���ˮ��̶������۵��뻹��ˮ��ij̶ȶ���С������c(H��)<c(HSO)����ȷ������Ũ�ȴ�С˳��Ϊ��c(Na��)��c(HSO)��c(H��)��c(SO![]() )��c(OH��)����D������
)��c(OH��)����D������
����Bѡ������ȷ����

 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�����Ŀ��ijѧϰС�����ӹ�ҵ�Ϸ������л���V2O5��ͨ������֪�÷Ϸ���������Ҫ�ɷ����±�:
���� | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
��������/% | 2.2��29 | 2.8��3.1 | 22��28 | 60��65 | 1��2 | <1 |
����ͨ�����������ҵ�һ�ַϷ������Ļ��չ�������·������:
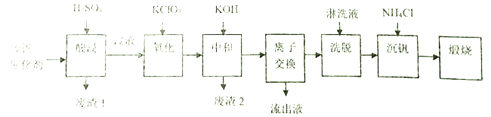
�ش���������:
��1���������ʱV2O5ת��ΪVO2+��V2O4ת��VO2+����������1������Ҫ�ɷ���_____________��
��2������������Ŀ����ʹVO2+��ΪVO2+��д���÷�Ӧ�����ӷ���ʽ________________________��
��3�����к�������֮һ��ʹ����V4O124-��ʽ��������Һ�У���������2���ijɷ���__________(�û�ѧʽ��ʾ)��
��4�������ӽ���������ϴ�����ɼ�ʾΪ:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROHΪ�����������ӽ�����֬)��������Һ����������������_______________��Ϊ�����ϴ��Ч�ʣ���ϴҺӦ�ó�______��(������������������������)��
R4V4O12+4OH-(ROHΪ�����������ӽ�����֬)��������Һ����������������_______________��Ϊ�����ϴ��Ч�ʣ���ϴҺӦ�ó�______��(������������������������)��
��5�����������õ�ƫ�����(NH4VO3)������д���õ������Ļ�ѧ����ʽ__________________��
����Ŀ������������(��NO2��NO4��N2O5��)Ӧ�úܹ㣬��һ�������¿����ת����
(1) ��֪��2NO(g)��O2(g)===2NO2(g)����H1
NO(g)��O3(g)===NO2(g)��O2(g)����H2
2NO2(g)![]() N2O4(g)����H3
N2O4(g)����H3
2N2O5(g)===4NO2(g)��O2(g)����H4
��ӦN2O4(g)��O3(g)===N2O5(g)��O2(g)�Ħ�H��__________��
(2)��N2O5��һ�������·����ֽ⣺2N2O5(g)===4NO2(g)��O2(g)��ij�¶��²�ú����ܱ�������N2O5Ũ����ʱ��ı仯���±���
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/ (mol��L��1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
�跴Ӧ��ʼʱ��ϵѹǿΪp0����2.00 minʱ��ϵѹǿΪp����p��p0��________��1.00��3.00 min�ڣ�O2��ƽ����Ӧ����Ϊ________��
(3)N2O4��NO2֮����ڷ�ӦN2O4(g)![]() 2NO2(g)����һ������N2O4��������ܱ������У������ƽ��ת����[��(N2O4)]���¶ȱ仯��ͼ��ʾ��
2NO2(g)����һ������N2O4��������ܱ������У������ƽ��ת����[��(N2O4)]���¶ȱ仯��ͼ��ʾ��

��ͼ��a���Ӧ�¶��£���֪N2O4����ʼѹǿp0Ϊ108 kPa����ʽ������¶��·�Ӧ��ƽ�ⳣ��Kp��________(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�������)��
����ͼ�Ʋ�N2O4(g)![]() 2NO2(g)�����ȷ�Ӧ���Ƿ��ȷ�Ӧ��˵������_______________����Ҫ���N2O4ת���ʣ����ı䷴Ӧ�¶��⣬������ʩ��____________(Ҫ��д������)��
2NO2(g)�����ȷ�Ӧ���Ƿ��ȷ�Ӧ��˵������_______________����Ҫ���N2O4ת���ʣ����ı䷴Ӧ�¶��⣬������ʩ��____________(Ҫ��д������)��