题目内容
U、V、W、X、Y为短周期元素,且原子半径依次增大,U、V同主族,V、W、X、Y处于同周期,U的最高价氧化物所对应的水化物与其气态氢化物反应生成盐A,U、W、Y的最高价氧化物对应的水化物能互相反应生成盐,Z为血红蛋白中所必需的金属元素,且U、W、Z分别能与氧元素形成U23、W2O3、Z2O3.回答下列问题:
(1)U的气态氢化物分子的电子式为______,盐A中阳离子的检验方法是______;
(2)元素V、W、X、Y的第一电离能的大小关系是:______,Z原子的最外层电子排布式______;
(3)W的单质与Y的最高价氧化物对应的水化物的溶液反应,其离子方程式是______;
(4)z单质与水在一定条件下反应的化学方程式为______ Fe3O4+4H2↑
【答案】分析:U、V、W、X、Y为短周期元素,且原子半径依次增大,U的最高价氧化物所对应的水化物与其气态氢化物反应生成盐A,说明U的氧化物的水化物是酸,氢化物是碱性气体,所以U是N元素,U、V同主族,所以V是P元素;Z为血红蛋白中所必需的金属元素,所以Z是Fe元素;U、W、Y的最高价氧化物对应的水化物能互相反应生成盐,U的最高价氧化物的水化物是酸,所以W、Y的最高价氧化物的水化物一种是碱,一种是两性氢氧化物,W的原子半径小于Y的原子半径,所以W是Al,Y是Na元素,且U、W、Z分别能与氧元素形成U23、W2O3、Z2O3 ,V、W、X、Y处于同周期,且X的半径大于W小于Y,所以X是Mg.
(1)根据共价化合物电子式的书写规则书写;铵根离子的检验方法是:和碱液反应生成氨气,然后用湿润的蓝色石蕊试纸检验,如果蓝色石蕊试纸变红则证明溶液中含有铵根离子.
(2)同一周期中,元素的第一电离能随着原子序数的增大而增大,注意镁的第一电离能大于铝的,同一主族中,元素的第一电离能随着原子序数的增大而减小;铁原子最外层上有2个电子.
(3)铝和氢氧化钠、水反应生成偏铝酸钠和氢气.
(4)高温条件下,铁和水反应生成四氧化三铁和氢气.
(5)Z(s)+ O2(g)=ZO(s)△H=-272.0KJ.mol-1 ①
O2(g)=ZO(s)△H=-272.0KJ.mol-1 ①
2W(s)+ O2(g)=W2O3(s)△H=-1675.7KJ.mol-1②
O2(g)=W2O3(s)△H=-1675.7KJ.mol-1②
将方程式②×2-①×3即得所求方程式,其焓变进行相应的相减即得所需方程式.
解答:解:U、V、W、X、Y为短周期元素,且原子半径依次增大,U的最高价氧化物所对应的水化物与其气态氢化物反应生成盐A,说明U的氧化物的水化物是酸,氢化物是碱性气体,所以U是N元素,U、V同主族,所以V是P元素;Z为血红蛋白中所必需的金属元素,所以Z是Fe元素;U、W、Y的最高价氧化物对应的水化物能互相反应生成盐,U的最高价氧化物的水化物是酸,所以W、Y的最高价氧化物的水化物一种是碱,一种是两性氢氧化物,W的原子半径小于Y的原子半径,所以W是Al,Y是Na元素,且U、W、Z分别能与氧元素形成U23、W2O3、Z2O3 ,V、W、X、Y处于同周期,且X的半径大于W小于Y,所以X是Mg.
(1)氨气的共价化合物,其电子式为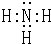 ;加热条件下,铵根离子和氢氧化钠反应生成氨气,氨气和水反应生成氨水,氨水溶液呈碱性,能使红色石蕊试纸变蓝色,所以检验铵根离子的方法是:取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子.
;加热条件下,铵根离子和氢氧化钠反应生成氨气,氨气和水反应生成氨水,氨水溶液呈碱性,能使红色石蕊试纸变蓝色,所以检验铵根离子的方法是:取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子.
故答案为: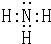 ;取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子.
;取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子.
(2)钠、镁、铝属于同一周期元素,同一周期中元素的第一电离能随着原子序数的增大而减小,但第ⅢA族元素的第一电离能小于第ⅡA元素的第一电离能,所以钠、镁、铝和磷的第一电离能的大小顺序是P>Mg>Al>Na;Z是铁元素,铁原子最外层上有2个电子,都排在4S能级上,所以Z原子的最外层电子排布式4s2.
故答案为:P>Mg>Al>Na;4s2.
(3)铝和氢氧化钠、水反应生成偏铝酸钠和氢气,其反应离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)高温条件下,铁和水反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O Fe3O4+4H2↑.
Fe3O4+4H2↑.
故答案为:3Fe+4H2O Fe3O4+4H2↑.
Fe3O4+4H2↑.
(5)Z(s)+ O2(g)=ZO(s)△H=-272.0KJ.mol-1 ①
O2(g)=ZO(s)△H=-272.0KJ.mol-1 ①
2W(s)+ O2(g)=W2O3(s)△H=-1675.7KJ.mol-1②
O2(g)=W2O3(s)△H=-1675.7KJ.mol-1②
将方程式②×2-①×3得3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)?△H=-859.7kJ/mol.
故答案为:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)?△H=-859.7kJ/mol.
点评:本题以元素推断为载体考查元素化合物的灼知识,能正确推断元素是解本题的关键,氨气的检验方法是考试的热点,铝和氢氧化钠溶液的反应中有水参加,这是易错的地方,注意铁和水蒸气反应生成四氧化三铁不是氧化铁.
(1)根据共价化合物电子式的书写规则书写;铵根离子的检验方法是:和碱液反应生成氨气,然后用湿润的蓝色石蕊试纸检验,如果蓝色石蕊试纸变红则证明溶液中含有铵根离子.
(2)同一周期中,元素的第一电离能随着原子序数的增大而增大,注意镁的第一电离能大于铝的,同一主族中,元素的第一电离能随着原子序数的增大而减小;铁原子最外层上有2个电子.
(3)铝和氢氧化钠、水反应生成偏铝酸钠和氢气.
(4)高温条件下,铁和水反应生成四氧化三铁和氢气.
(5)Z(s)+
 O2(g)=ZO(s)△H=-272.0KJ.mol-1 ①
O2(g)=ZO(s)△H=-272.0KJ.mol-1 ①2W(s)+
 O2(g)=W2O3(s)△H=-1675.7KJ.mol-1②
O2(g)=W2O3(s)△H=-1675.7KJ.mol-1②将方程式②×2-①×3即得所求方程式,其焓变进行相应的相减即得所需方程式.
解答:解:U、V、W、X、Y为短周期元素,且原子半径依次增大,U的最高价氧化物所对应的水化物与其气态氢化物反应生成盐A,说明U的氧化物的水化物是酸,氢化物是碱性气体,所以U是N元素,U、V同主族,所以V是P元素;Z为血红蛋白中所必需的金属元素,所以Z是Fe元素;U、W、Y的最高价氧化物对应的水化物能互相反应生成盐,U的最高价氧化物的水化物是酸,所以W、Y的最高价氧化物的水化物一种是碱,一种是两性氢氧化物,W的原子半径小于Y的原子半径,所以W是Al,Y是Na元素,且U、W、Z分别能与氧元素形成U23、W2O3、Z2O3 ,V、W、X、Y处于同周期,且X的半径大于W小于Y,所以X是Mg.
(1)氨气的共价化合物,其电子式为
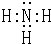 ;加热条件下,铵根离子和氢氧化钠反应生成氨气,氨气和水反应生成氨水,氨水溶液呈碱性,能使红色石蕊试纸变蓝色,所以检验铵根离子的方法是:取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子.
;加热条件下,铵根离子和氢氧化钠反应生成氨气,氨气和水反应生成氨水,氨水溶液呈碱性,能使红色石蕊试纸变蓝色,所以检验铵根离子的方法是:取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子.故答案为:
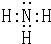 ;取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子.
;取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子.(2)钠、镁、铝属于同一周期元素,同一周期中元素的第一电离能随着原子序数的增大而减小,但第ⅢA族元素的第一电离能小于第ⅡA元素的第一电离能,所以钠、镁、铝和磷的第一电离能的大小顺序是P>Mg>Al>Na;Z是铁元素,铁原子最外层上有2个电子,都排在4S能级上,所以Z原子的最外层电子排布式4s2.
故答案为:P>Mg>Al>Na;4s2.
(3)铝和氢氧化钠、水反应生成偏铝酸钠和氢气,其反应离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)高温条件下,铁和水反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O
 Fe3O4+4H2↑.
Fe3O4+4H2↑.故答案为:3Fe+4H2O
 Fe3O4+4H2↑.
Fe3O4+4H2↑.(5)Z(s)+
 O2(g)=ZO(s)△H=-272.0KJ.mol-1 ①
O2(g)=ZO(s)△H=-272.0KJ.mol-1 ①2W(s)+
 O2(g)=W2O3(s)△H=-1675.7KJ.mol-1②
O2(g)=W2O3(s)△H=-1675.7KJ.mol-1②将方程式②×2-①×3得3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)?△H=-859.7kJ/mol.
故答案为:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)?△H=-859.7kJ/mol.
点评:本题以元素推断为载体考查元素化合物的灼知识,能正确推断元素是解本题的关键,氨气的检验方法是考试的热点,铝和氢氧化钠溶液的反应中有水参加,这是易错的地方,注意铁和水蒸气反应生成四氧化三铁不是氧化铁.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

