题目内容
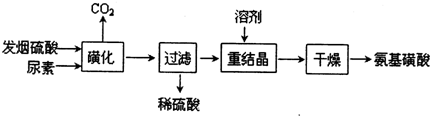
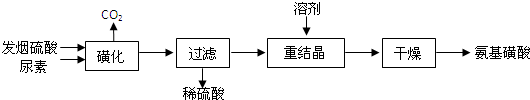
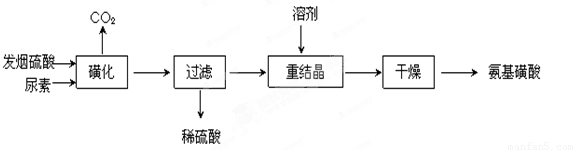
氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇。在工业上用作酸性清洗剂、阻燃剂、磺化剂。用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的路线如下:
(1)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是______________
(2)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s) + SO3(g) 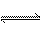 H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0
②H2NCONHSO3H + H2SO4 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是_______________ 。
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。试求产品中氨基磺酸的质量分数 。
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有___________杂质。
(1)氨基磺酸在硫酸溶液中的溶解度比在水中的溶解度小。(2分)
(2)温度高,SO3气体逸出加 快
快 ,使反
,使反 应①转化率降低。温度高,反应①平衡向逆反应方向移动。(2分)
应①转化率降低。温度高,反应①平衡向逆反应方向移动。(2分)
(3)H2N SO3H+NaNO
SO3H+NaNO 2=NaHSO4+N2↑+H2O。或写出关系式H2NSO3H~NaNO2
2=NaHSO4+N2↑+H2O。或写出关系式H2NSO3H~NaNO2
n (H2NSO3H)=n(NaNO2)=25. 00×l0—3 × 0.08000 mol·L-1=2.000×l0—3 mol ω(H2NSO3H)= 98.0%
mol·L-1=2.000×l0—3 mol ω(H2NSO3H)= 98.0% (4分)
(4分)
(4)硫酸 (2分)
解析

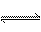 H2NCONHSO3H(s)
△H<0
H2NCONHSO3H(s)
△H<0