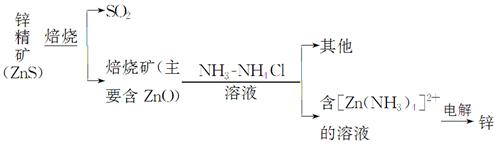
题目内容
甲元素的原子序数是11,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位于第________周期;乙元素在周期表中位于第________族;丙元素的名称为________。
(2)甲的单质与水反应的离子方程式为__________________________。乙单质与丙单质反应的化学方程式为______________________________________________________。
(1)三 ⅥA 锂
(2)2Na+2H2O=2Na++2OH-+H2↑ 4Li+O2 2Li2O
2Li2O
解析

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目

 H2(g)+
H2(g)+ S2(g)
S2(g)