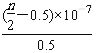题目内容
【题目】【2014新课标1】乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式
(2)已知:
甲醇脱水反应 ① 2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol-1
甲醇制烯烃反应 ② 2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1KJ·mol-1
乙醇异构化反应 ③ CH3CH2OH(g)=CH3OCH3(g)) △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H= KJ·mol-1
与间接水合法相比,气相直接水合法的优点是: 。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O)︰n(C2H4)=1︰1)
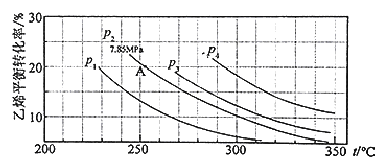
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是:
③气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有: 、 。
【答案】(1)C2H4+H2SO4= C2H5OSO3H ; C2H5OSO3H+H2O=C2H5OH+ H2SO4;
(2)-45.5 污染小,腐蚀性小等;
(3)①K=0.07(MPa)-1; ②P1< P2< P3< P4;反应分子数减少,相同温度下,压强升高,乙烯转化率提高; ③ 将产物乙醇液化转移去,增加n(H2O):n(C2H4)的比。
【解析】
(1)根据题意可得乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)的方程式:C2H4+H2SO4= C2H5OSO3H; 硫酸氢乙酯发生水解反应得到乙醇:C2H5OSO3H+H2O=C2H5OH+ H2SO4;(2)根据盖斯定律可知:化学反应放出的能量多少与反应途径无关,而只与物质的开始状态及终止状态有关。将几个方程式进行叠加:①-②-③,整理可得C2H4 (g)+H2O(g)=C2H5OH(g),△H=(-23.9+29.1-50.7)KJ/mol=-45.5 KJ/mol;通过比较气相直接水合法和间接水合法使用的原料、产物可以发现:气相直接水合法具有污染小,腐蚀性小等的优点;(3)①乙烯水合制乙醇反应在图中A点的平衡常数K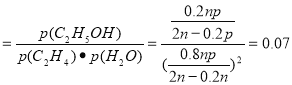 (MPa)-1; ②在相同的温度下由于乙烯是平衡转化率是P1< P2< P3< P4;由方程式C2H4 (g)+H2O(g)=C2H5OH(g)可知该反应的正反应是气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是:P1< P2< P3< P4; ③若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有改变物质的浓度,如从平衡体系中将产物乙醇分离出去,或增大水蒸气的浓度,改变n(H2O):n(C2H4)比等等。
(MPa)-1; ②在相同的温度下由于乙烯是平衡转化率是P1< P2< P3< P4;由方程式C2H4 (g)+H2O(g)=C2H5OH(g)可知该反应的正反应是气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是:P1< P2< P3< P4; ③若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有改变物质的浓度,如从平衡体系中将产物乙醇分离出去,或增大水蒸气的浓度,改变n(H2O):n(C2H4)比等等。