题目内容
【题目】(1)汽车尾气是城市空气污染的一个重要因素,一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,在高温熔融状态下能传导O2-(过程中无气体产生),则负极的反应式为___。
(2)以上述电池为电源,通过导线连接成图一电解池。

①若X、Y为石墨,a为2L0.1mol/LKCl溶液,写出电解总反应的离子方程式___。
②若X、Y分别为铜、银,a为1L0.2mol/LAgNO3溶液,写出Y电极反应式___。
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。

①结合图二计算,上述电解过程中消耗一氧化碳的质量为___g。
②若图二的B点pH=7,则滴定终点在___区间(填“AB”、“BC”或“CD”)。
【答案】CO+2O2--2e-=CO32- 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- Ag-e-=Ag+ 2.8 AB
Cl2↑+H2↑+2OH- Ag-e-=Ag+ 2.8 AB
【解析】
(1)CO发生氧化反应与O2-结合生成CO32-;
(2)①阳极上氯离子失电子,阴极上阳离子得电子;
②Y为阳极,阳极上银失电子生成银离子;
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.4mol/L醋酸得到图三;
①根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据KOH和转移电子正极的关系式计算转移电子,再根据转移电子守恒计算CO的质量;
②滴定终点二者恰好反应生成CH3COOK。
![]() 负极CO发生氧化反应与
负极CO发生氧化反应与![]() 结合生成
结合生成![]() ,负极电极反应式为:
,负极电极反应式为:![]() ;
;
![]() 阳极上氯离子失电子,阴极上阳离子得电子,所以电解
阳极上氯离子失电子,阴极上阳离子得电子,所以电解![]() 溶液,其电解总反应的离子方程式为:
溶液,其电解总反应的离子方程式为: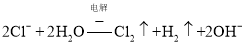 ;
;
![]() 为阳极,阳极上银失电子生成银离子,其电极反应为:
为阳极,阳极上银失电子生成银离子,其电极反应为:![]() ;
;
![]() 室温时,按上述
室温时,按上述![]() 电解一段时间后,取25mL上述电解后溶液,滴加
电解一段时间后,取25mL上述电解后溶液,滴加![]() 醋酸得到图三;
醋酸得到图三;
![]() 根据图知,KOH溶液的
根据图知,KOH溶液的![]() ,常温下,KOH的浓度是
,常温下,KOH的浓度是![]() ,则
,则![]() ,根据
,根据 知,生成
知,生成![]() 氢氧根离子转移电子的物质的量
氢氧根离子转移电子的物质的量![]() ,燃料电池的负极反应方程式是
,燃料电池的负极反应方程式是![]() ,消耗1molCO转移电子数
,消耗1molCO转移电子数![]() ,因此当转移
,因此当转移![]() 电子时消耗CO的物质的量为
电子时消耗CO的物质的量为![]() ,则CO的质量
,则CO的质量![]() ;
;
![]() 滴定终点二者恰好反应生成
滴定终点二者恰好反应生成![]() ,KOH的浓度是醋酸的一半,则恰好中和时需要酸的体积等于KOH体积的一半,醋酸钾为强碱弱酸盐,其溶液呈碱性,当溶液的
,KOH的浓度是醋酸的一半,则恰好中和时需要酸的体积等于KOH体积的一半,醋酸钾为强碱弱酸盐,其溶液呈碱性,当溶液的![]() 时,醋酸稍微过量,所以醋酸体积大于KOH体积的一半,所以滴定终点为AB段,故答案为:AB。
时,醋酸稍微过量,所以醋酸体积大于KOH体积的一半,所以滴定终点为AB段,故答案为:AB。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】已知:H2(g)+I2(g)![]() 2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
起始浓度 | c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)(mol·L-1) |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
② | 0 | 0 | 1 | 4 | 热量变化:QkJ |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①时CO的反应速率等于H2O的反应速率
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照以下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2%H2O2溶液 | 无 |
② | 10mL5%H2O2溶液 | 无 |
③ | 10mL5%H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
④ | 10mL5%H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(1)实验①和②的目的是___。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1。分析图1能够得出的实验结论是__。

(3)加入0.1gMnO2粉末于50mLH2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示。反应速率变化的原因是__。

