题目内容
18.将10mL0.21mol/LHCl和10mL0.1mol/LBa(OH)2溶液混合,在用水稀释至5L,取出10mL,滴入甲基橙试剂,溶液显示的颜色是( )| A. | 黄色 | B. | 红色 | C. | 蓝色 | D. | 橙色 |
分析 常温下,将10mL0.21mol.L-1的HCl溶液n(H+)=0.01L×0.21mol/L=0.0021mol,10mL0.1mol.L-1的Ba(OH)2溶液n(OH-)=2×0.01L×0.1mol/L=0.002mol,酸过量,反应后溶液呈酸性,计算反应后c(H+),可计算pH,结合甲基橙变色范围分析判断.
解答 解:常温下,将10mL0.21mol.L-1的HCl溶液n(H+)=0.01L×0.21mol/L=0.0021mol,10mL0.1mol.L-1的Ba(OH)2溶液n(OH-)=2×0.01L×0.1mol/L=0.002mol,酸过量,反应后溶液呈酸性,计算反应后c(H+)=$\frac{0.0021mol-0.002mol}{5L}$=2×10-5mol/L,可计算pH=5-lg2=5-0.301=4.7,甲基橙变色范围为3.1--4.4为橙色,所以取出10mL滴入甲基橙试剂,则溶液显示的颜色显黄色;
故选A.
点评 本题考查有关混合物反应pH的简单计算,该题是高考中的常见题型,属于难度不大的试题,试题贴近高考,旨在培养学生分析、归纳和总结问题的能力,关键是注意酸碱物质的量的计算和过量问题,把握相关计算公式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.现有三组化合物:①汽油和氯化钠溶液 ②乙醇的水溶液 ③溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、蒸发、萃取 | B. | 分液、蒸馏、萃取 | C. | 萃取、蒸发、分液 | D. | 萃取、分液、蒸馏 |
9.下列属于取代反应的是( )
| A. | H2C=CH2+H2$\stackrel{催化剂}{→}$H3C-CH3 | B. | 2CH3CH2OH+O2$\stackrel{Cu/△}{→}$2CH3CHO+2H2O | ||
| C. | 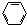 +3H2$\stackrel{Ni/△}{→}$ +3H2$\stackrel{Ni/△}{→}$ | D. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl |
6.下列电离方程式中,正确的是( )
| A. | Fe2(SO4)3═2Fe+3+3SO4-2 | B. | Ba(OH)2═Ba2++2(OH-) | ||
| C. | H2SO4═2H++SO42- | D. | Na2CO3═Na2++CO32- |
13. 化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图所示是A的转化率同压强,温度的关系,分析图象可以得出的正确结论是( )
化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图所示是A的转化率同压强,温度的关系,分析图象可以得出的正确结论是( )
 化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图所示是A的转化率同压强,温度的关系,分析图象可以得出的正确结论是( )
化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图所示是A的转化率同压强,温度的关系,分析图象可以得出的正确结论是( )| A. | 正反应吸热,m+n<ρ+q | B. | 正反应吸热,m+n>ρ+q | ||
| C. | 正反应放热,m+n<ρ+q | D. | 正反应放热:m+n>ρ+q |
10.硫酸的工业制备中,混合气体的组成是:SO2占7%、O2占11%,其余的是N2和CO2,现有100体积混合气体进入接触室反应后,导出的气体恢复到原温度和压强,变为97.2体积,则SO2的转化率约为( )
| A. | 60% | B. | 70% | C. | 80% | D. | 90% |
14.在标准状况时,下列物质的体积约为22.4L的是( )
| A. | 1 mol H2O | B. | 16 g O2 | C. | 1 mol Fe | D. | 2 g H2 |
15.把2a mol H2和b mol C2H4混合,在一定条件下生成了2c mol C2H6,将反应后的混合气体完全燃烧,消耗氧气的物质的量为( )
| A. | 2a+3b | B. | a+3b | C. | a+3b+7c | D. | 2a+3b+7c |