题目内容
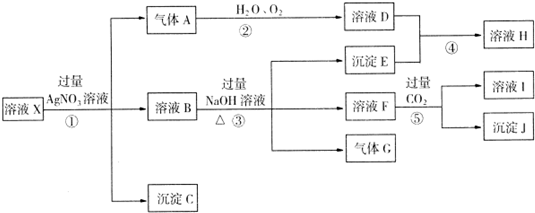
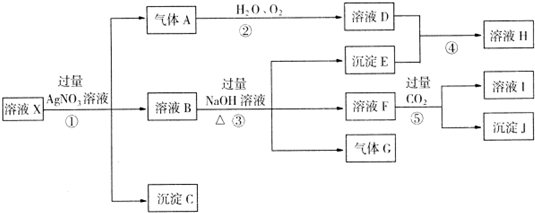
某强酸性溶液X,含Ag+、Al3+、SiO2-3、NH+4、Fe2+、Fe3+、CO2-3、Cl-、NO-3中的一种或几种离子,取X溶液进行连续实验,能实现如下转化:

依据以上信息,回答下列问题:
(1)上述离子中,溶液x中肯定含有的是:______;不能肯定的是:______;对不能确定是否存在的离子,可以另取x溶液于一支试管中,选择下列试剂中的某一种加入X溶液,根据现象就可判断,则试剂可以选(若多种选法中间加“或“字间隔):______.
①酚酞试剂,②石蕊试剂,③pH试纸,④KSCN溶液,⑤KMnO4溶液,⑥苯酚溶液
(2)气体G的化学式为:______;沉淀E的化学式为:______;沉淀J的化学式为:______.
(3)实验中,产生的气体A为无色,但如果暴露在空气中可以观察到的现象是:______;写出步骤①中生成气体A的离子方程式______.
(4)要使步骤②中,A、H2O、O2三种物质恰好发生化合反应,则A、H2O、O2物质的量之比是:______.
解:在强酸性溶液中一定不会存在CO32-和SiO32-离子,加入过量硝酸银生成沉淀,则该沉淀为氯化银沉淀,说明溶液中含有氯离子,生成气体A,A可以和氧气水反应生成溶液D,依据离子分析只有Fe2+在酸性溶液中加入硝酸银后会形成稀硝酸氧化亚铁离子为三价铁离子,本身被还原为一氧化氮气体,则A为NO,D为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体G,则G为NH3,说明溶液中含有NH4+离子,过量氢氧化钠溶液中生成沉淀E是Fe(OH)3,溶液F中通入过量二氧化碳会生成沉淀J,则J为Al(OH)3,I为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有Cl-离子就一定不含Ag+离子,不能确定是否含有的离子Fe3+,以此解答;
(1)依据分析判断溶液x中肯定含有的是:Cl-、Al3+、Fe2+、NH4+;不能确定的是Fe3+,依据三甲胺铁离子的特征性质进行鉴别;①酚酞试剂,是酸碱指示剂,不能检验三价铁的存在;②石蕊试剂,是酸碱指示剂,不能检验三价铁的存在;③pH试纸,是测定溶液酸碱性,不能检验三价铁的存在;④KSCN溶液,与三价铁离子反应生成血红色溶液,可以检验;⑤KMnO4溶液,无变化,不能检验三价铁离子;⑥苯酚溶液和三价铁离子形成紫色溶液,可以检验;
故答案为:Cl-、Al3+、Fe2+、NH4+;Fe3+;④⑥;
(2)依据上述分析判断,气体G的化学式为:NH3;沉淀E为的化学式为:Fe(OH)3;沉淀J的化学式为:Al(OH)3;故答案为:NH3;Fe(OH)3;Al(OH)3;
(3)实验中,产生的气体A为无色的一氧化氮气体,但如果暴露在空气中可以观察到的现象是从无色变化为红棕色,步骤①中生成气体A为NO,反应是亚铁离子被酸性溶液中的硝酸根离子氧化为三价铁离子,反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
故答案为:无色变化为红棕色;3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)要使步骤②中,NO、H2O、O2三种物质恰好发生化合反应生成硝酸,发生的反应是4NO+3O2+2H2O=4HNO3;则A(NO)、H2O、O2物质的量之比是:4:3:2;
故答案为:4:3:2;
分析:在强酸性溶液中一定不会存在CO32-和SiO32-离子,加入过量硝酸银生成沉淀,则该沉淀为氯化银沉淀,说明溶液中含有氯离子,生成气体A,A可以和氧气水反应生成溶液D,依据离子分析只有Fe2+在酸性溶液中加入硝酸银后会形成稀硝酸氧化亚铁离子为三价铁离子,本身被还原为一氧化氮气体,则A为NO,D为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体G,则G为NH3,说明溶液中含有NH4+离子,过量氢氧化钠溶液中生成沉淀E是Fe(OH)3,溶液F中通入过量二氧化碳会生成沉淀J,则J为Al(OH)3,I为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有Cl-离子就一定不含Ag+离子,不能确定是否含有的离子Fe3+,以此解答;
点评:本题考查了物质转化关系的分析判断和物质性质的综合应用,盐类水解的应用,离子共存的分析判断,化学反应特征的推断,题目难度较大.
(1)依据分析判断溶液x中肯定含有的是:Cl-、Al3+、Fe2+、NH4+;不能确定的是Fe3+,依据三甲胺铁离子的特征性质进行鉴别;①酚酞试剂,是酸碱指示剂,不能检验三价铁的存在;②石蕊试剂,是酸碱指示剂,不能检验三价铁的存在;③pH试纸,是测定溶液酸碱性,不能检验三价铁的存在;④KSCN溶液,与三价铁离子反应生成血红色溶液,可以检验;⑤KMnO4溶液,无变化,不能检验三价铁离子;⑥苯酚溶液和三价铁离子形成紫色溶液,可以检验;
故答案为:Cl-、Al3+、Fe2+、NH4+;Fe3+;④⑥;
(2)依据上述分析判断,气体G的化学式为:NH3;沉淀E为的化学式为:Fe(OH)3;沉淀J的化学式为:Al(OH)3;故答案为:NH3;Fe(OH)3;Al(OH)3;
(3)实验中,产生的气体A为无色的一氧化氮气体,但如果暴露在空气中可以观察到的现象是从无色变化为红棕色,步骤①中生成气体A为NO,反应是亚铁离子被酸性溶液中的硝酸根离子氧化为三价铁离子,反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
故答案为:无色变化为红棕色;3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)要使步骤②中,NO、H2O、O2三种物质恰好发生化合反应生成硝酸,发生的反应是4NO+3O2+2H2O=4HNO3;则A(NO)、H2O、O2物质的量之比是:4:3:2;
故答案为:4:3:2;
分析:在强酸性溶液中一定不会存在CO32-和SiO32-离子,加入过量硝酸银生成沉淀,则该沉淀为氯化银沉淀,说明溶液中含有氯离子,生成气体A,A可以和氧气水反应生成溶液D,依据离子分析只有Fe2+在酸性溶液中加入硝酸银后会形成稀硝酸氧化亚铁离子为三价铁离子,本身被还原为一氧化氮气体,则A为NO,D为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体G,则G为NH3,说明溶液中含有NH4+离子,过量氢氧化钠溶液中生成沉淀E是Fe(OH)3,溶液F中通入过量二氧化碳会生成沉淀J,则J为Al(OH)3,I为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有Cl-离子就一定不含Ag+离子,不能确定是否含有的离子Fe3+,以此解答;
点评:本题考查了物质转化关系的分析判断和物质性质的综合应用,盐类水解的应用,离子共存的分析判断,化学反应特征的推断,题目难度较大.

练习册系列答案
相关题目