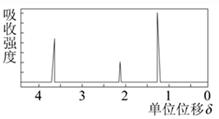
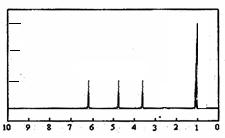
题目内容
某有机物1.5g在氧气中完全燃烧,生成0.1mol水和1.68L(标准状况)二氧化碳。该有机物的蒸气对空气的相对密度是2.07,求其分子式。
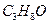
设碳为 克,氢元素为
克,氢元素为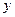 克,则
克,则
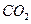 ~ C
~ C 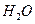 ~ 2H
~ 2H
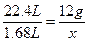


解得: ="0.9g" y=0.2g
="0.9g" y=0.2g
此种物质含氧元素的质量为:1.5-0.9-0.2=0.4g
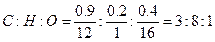 最简式为:
最简式为: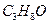 ,式量=60
,式量=60
相对分子质量为:M=
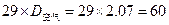 n=
n=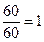
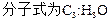
 克,氢元素为
克,氢元素为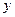 克,则
克,则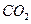 ~ C
~ C 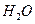 ~ 2H
~ 2H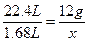


解得:
 ="0.9g" y=0.2g
="0.9g" y=0.2g此种物质含氧元素的质量为:1.5-0.9-0.2=0.4g
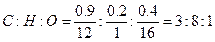 最简式为:
最简式为: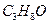 ,式量=60
,式量=60相对分子质量为:M=

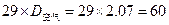 n=
n=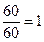

练习册系列答案
相关题目
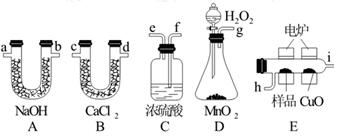
 )产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是g→f→(____)→(____)→(____)→c→d→a→b→(____)。(有必要装置可以多次选择)
)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是g→f→(____)→(____)→(____)→c→d→a→b→(____)。(有必要装置可以多次选择)