题目内容
氯化铜的稀溶液是淡蓝色的,加入浓盐酸后,溶液变成黄绿色了,这种颜色变化是由下列可逆反应造成的:Cu(H2O)42+(溶液)+4Cl-CuCl42-(溶液)+4H2O,其中Cu(H2O)42+为淡蓝色,CuCl42-为黄绿色。下列方法 ①加蒸馏水,②加AgNO3固体,③加入NaCl固体,④加入过量NaOH溶液中,能使溶液变成淡蓝色的是:
A.只有① B.只有② C.①和② D.③和④
C
解析:考查外界条件对平衡的影响。要使溶液变成淡蓝色,则该反应需要向逆反应方向移动①可以。加AgNO3固体会生成氯化银沉淀,降低反应物Cl-浓度,平衡向逆反应方向移动,②正确。加入NaCl固体,增大反应物Cl-浓度,平衡向正反应方向移动,③不正确。加入过量NaOH溶液中,会生成氢氧化铜沉淀,④不正确。答案选C。

练习册系列答案
相关题目
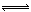 CuCl42-(溶液)+4H2O,其中Cu(H2O)42+为淡蓝色,CuCl42-为黄绿色。下列方法 ①加蒸馏水,②加AgNO3固体,③加入NaCl固体,④加入过量NaOH溶液中,能使溶液变成淡蓝色的是:
CuCl42-(溶液)+4H2O,其中Cu(H2O)42+为淡蓝色,CuCl42-为黄绿色。下列方法 ①加蒸馏水,②加AgNO3固体,③加入NaCl固体,④加入过量NaOH溶液中,能使溶液变成淡蓝色的是: CuCl42-(溶液)+4H2O,其中Cu(H2O)42+为淡蓝色,CuCl42-为黄绿色。下列方法 ①加蒸馏水,②加AgNO3固体,③加入NaCl固体,④加入过量NaOH溶液中,能使溶液变成淡蓝色的是:
CuCl42-(溶液)+4H2O,其中Cu(H2O)42+为淡蓝色,CuCl42-为黄绿色。下列方法 ①加蒸馏水,②加AgNO3固体,③加入NaCl固体,④加入过量NaOH溶液中,能使溶液变成淡蓝色的是: