题目内容
【题目】下列事实不能用平衡移动原理解释的是
A.配制FeCl3溶液时加入少量的浓盐酸
B.常温下,NaOH溶液中由水电离出的c(H+)<1×10-7mol/L
C.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度
D.工业上SO2转化为SO3用五氧化二钒铁触媒作为催化剂
【答案】D
【解析】
试题分析:A、Fe3+发生水解,Fe3++3H2O![]() Fe(OH)3+3H+,加入盐酸增加H+浓度,平衡逆向移动,符合勒夏特列原理,故错误;B、H2O
Fe(OH)3+3H+,加入盐酸增加H+浓度,平衡逆向移动,符合勒夏特列原理,故错误;B、H2O![]() H++OH-,加入NaOH,增加OH-浓度,抑制水的电离,符合勒夏特列原理,故错误;C、氯化银存在溶解平衡体系:AgCl(s)=Ag+(aq)+Cl-(aq),加入氯化钠后,增加Cl-的浓度,平衡向逆反应方向移动,符合勒夏特列原理,故错误;D、催化剂不影响化学平衡,不符合勒夏特列原理,故正确。
H++OH-,加入NaOH,增加OH-浓度,抑制水的电离,符合勒夏特列原理,故错误;C、氯化银存在溶解平衡体系:AgCl(s)=Ag+(aq)+Cl-(aq),加入氯化钠后,增加Cl-的浓度,平衡向逆反应方向移动,符合勒夏特列原理,故错误;D、催化剂不影响化学平衡,不符合勒夏特列原理,故正确。

 阅读快车系列答案
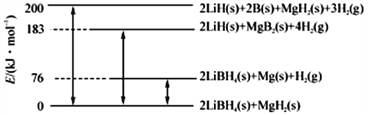
阅读快车系列答案【题目】Ⅰ.开发新能源,新材料是实现社会可持续发展的需要。下图是LiBH4/MgH2体系放氢的焓变示意图,则Mg(s)+2B(s)==MgB2(s)的ΔH=_________kJ·mol-1。
Ⅱ.在1.0L恒容密闭容器中放入0.10mol A(g),在一定温度时进行如下反应:A(g)==2B(g)+C(g)+D(S) ΔH=+85.1kJ·mol-1。
容器内气体总压强P与起始压强P0的比值随反应时间变化数据见下表:
时间t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
P/P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题:
(1)下列能提高A的转化率的是______________。
A.升高温度 B.向体系中通入气体A
C. 减少D的物质的量 D.向体系中通入稀有气体
(2)下列说法能表明该反应达到化学平衡状态的是_______________。
A.A、B、C的物质的量之比为1∶2∶1 B.单位时间内生成2n mol B,同时生成n mol C
C.容器中气体的密度不变 D.容器中气体的平均摩尔质量不变
(3)达到平衡状态时A的转化率是________(结果保留两位有效数字)。
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的取值范围为n(D)_______ mol。
(5)相同条件下,若将容器改为恒压容器,进行上述反应,某时刻,A的转化率为75%,则此时B的物质的量浓度为______________mol/L。