��Ŀ����
����Ŀ����һδ֪����ɫ��Һ��ֻ���ܺ������������е������֣�������ˮ���������H+��OH������H+��NH4+��K+��Mg2+��Cu2+��Al3+��NO3����CO32����SO42�� �� ��ȡ����100mL��Һ��������ʵ�飺 �ٵ�һ�ݼ�����AgNO3��Һ���а�ɫ����������
�ڵڶ��ݼ�����BaCl2��Һ���а�ɫ������������ϴ�ӡ������������Ϊ6.99g��
�۵�������εμ�NaOH��Һ����ó�����NaOH��Һ�������ϵ��ͼ��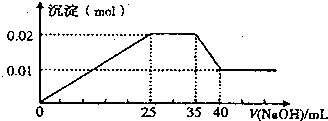
��������ʵ�飬�����Ʋⲻ��ȷ���ǣ� ��
A.ԭ��Һһ��������H+��Cu2+��CO32��
B.����ȷ��ԭ��Һ�Ƿ���K+��NO3��
C.ʵ�����ӵ�NaOH��Ũ��Ϊ2molL��1
D.ԭ��Һȷ����Mg2+��Al3+��NH4+ �� ��n��Mg2+����n��Al3+����n��NH4+��=1��1��2
���𰸡�B
���������⣺��Һ����ɫ���ģ����Բ�������ɫ�����ӣ���Cu2+һ�������ڣ�ͨ��ͼ��֪���ڼ��������NaOH�Ĺ����У�һ��ʼ���г������ɣ�˵��������H+�����������ܽ⣬�ƶ�һ������Al3+��K+���ܺ���ѧ�������ʷ�Ӧ����������������жϣ�ֻ������ɫ��Ӧ�жϣ�����ȷ���Ƿ�K+���ٵ�һ�ݼ�����AgNO3��Һ���а�ɫ�����������ƶ�һ����CO32����SO42�������е�һ�֣���ͨ��ͼ��֪����Al3+�������Ӻ�̼������ӷ���˫ˮ�⣬���ܹ��棬�����ƶ�һ��������CO32����һ������SO42�����ڵڶ��ݼ�����BaCl2 ��Һ���а�ɫ������������ϴ�ӡ������������Ϊ6.99g���ƶ�����3��10��2molBaSO4 �� ����n��SO42����=3��10��2mol���۵�������εμ�NaOH ��Һ����ó�����NaOH��Һ�������ϵ��ͼ��ͨ��ͼ��֪���ڼ�������Ĺ������ƵĹ����У�һ��ʼ���г������ɣ�˵��������H+ �� ���������ܽ⣬�ƶ�һ������Al3+��ͼ������һ��ƽ̨��˵������OH��ʱ�������ɣ���NH4+ �� NH4++OH��=NH3H2O�������Һ���г�����˵����Һ�к�Mg2+ �� ͨ����ʵ�����ж��Ƿ���K+ �� A��������������֪��ԭ��Һһ��������H+��Cu2+��CO32�� �� ��A��ȷ��B��ԭ��Һȷ������Mg2+��Al3+��NH4+ �� ��ͼ��֪���������ʱ��������þ������������������n[Mg��OH��2]+n[Al��OH��3]=0.02mol��������Сʱ��Ϊ������þ����n[Mg��OH��2]=0.01mol����n[Al��OH��3]=0.02mol��0.01mol=0.01mol��������Ԫ���غ��֪n��Al3+��=n[Al��OH��3]=0.01mol������Al3++3OH��=Al��OH��3������OH��0.03mol������þԪ���غ��֪ԭ��Һ��n��Mg2+��=n[Mg��OH��2]=0.01mol������Mg2++2OH��=Mg��OH��2������OH��0.02mol�����ɳ��������ʱ��OH��0.05mol����ͼ��֪����Na0H25mL������c��Na0H ��= ![]() =
= ![]() =2molL��1������NH4++OH��=NH3H2O�����Կɵõ�NH4+�����ʵ���Ϊ0.01L��2molL��1=2��10��2mol����n��Mg2+����n��Al3+����n��NH4+����n��SO42�����T0.01mol��0.01mol��2��10��2mol��3��10��2mol=1��1��2��3���ɵ���غ��֪1��2+1��3+2��1��3��2����Ӧ����NO3�� �� ��B����C����ѡ��B�ļ����֪��ʵ�����ӵ�NaOH��Ũ��Ϊ2molL��1 �� ��C��ȷ��D����ѡ��B�ļ����֪��ԭ��Һȷ����Mg2+��Al3+��NH4+ �� ��n��Mg2+����n��Al3+����n��NH4+��=1��1��2����D��ȷ����ѡB��
=2molL��1������NH4++OH��=NH3H2O�����Կɵõ�NH4+�����ʵ���Ϊ0.01L��2molL��1=2��10��2mol����n��Mg2+����n��Al3+����n��NH4+����n��SO42�����T0.01mol��0.01mol��2��10��2mol��3��10��2mol=1��1��2��3���ɵ���غ��֪1��2+1��3+2��1��3��2����Ӧ����NO3�� �� ��B����C����ѡ��B�ļ����֪��ʵ�����ӵ�NaOH��Ũ��Ϊ2molL��1 �� ��C��ȷ��D����ѡ��B�ļ����֪��ԭ��Һȷ����Mg2+��Al3+��NH4+ �� ��n��Mg2+����n��Al3+����n��NH4+��=1��1��2����D��ȷ����ѡB��