题目内容
已知:①向KMnO4晶体滴加浓盐酸,产生某黄绿色气体:
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断中正确的是
- A.①中产生气体的电子式是Cl:Cl
- B.上述实验中,共有两个氧化还原反应
- C.实验②中FeCl2被氧化
- D.实验③发生的是同主族元素单质间的置换反应
分析:A.氯气中的Cl原子满足最外层8个电子稳定结构;
B.上述三个反应中均有元素的化合价变化;
C.实验②中Fe元素的化合价升高;
D.实验③发生铁离子与碘离子的氧化还原反应.
解答:A.①中产生气体的电子式是
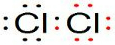 ,故A错误;
,故A错误;B.上述三个反应中均有元素的化合价变化,则均属于氧化还原反应,故B错误;
C.实验②中Fe元素的化合价升高,则FeCl2被氧化,故C正确;
D.实验③发生铁离子与碘离子的氧化还原反应,不是同主族元素单质间的置换反应,故D错误;
故选C.
点评:本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,注意把握发生的三个反应,题目难度不大.

I.实验室有一瓶失去标签的某白色固体,已知其成份可能是碳酸或亚硫酸的钠盐或钾盐,
且其成分单一。现某化学小组通过如下步骤来确定其成分:
⑴阳离子的确定:
实验方法及现象: 。
结论:此白色固体是钠盐。
⑵阴离子的确定:
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需补做如下实验:取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀。
II.确认其成分后,由于某些原因,此白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤I 称取样品1.000 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
⑴写出步骤III所发生反应的离子方程式 。
⑵在配制0.01 mol·L-1 KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量 (填“偏大”、“偏小”或“无影响”)
⑶滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
则该变质固体中X的质量分数为 。
I.实验室有一瓶失去标签的某白色固体,已知其成份可能是碳酸或亚硫酸的钠盐或钾盐,
且其成分单一。现某化学小组通过如下步骤来确定其成分:
⑴阳离子的确定:
实验方法及现象: 。
结论:此白色固体是钠盐。
⑵阴离子的确定:
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需补做如下实验:取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀。
II.确认其成分后,由于某些原因,此白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤I 称取样品1.000 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
⑴写出步骤III所发生反应的离子方程式 。
⑵在配制0.01 mol·L-1 KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量 (填“偏大”、“偏小”或“无影响”)
⑶滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
则该变质固体中X的质量分数为 。
